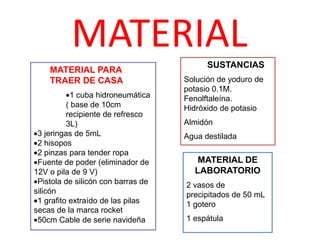
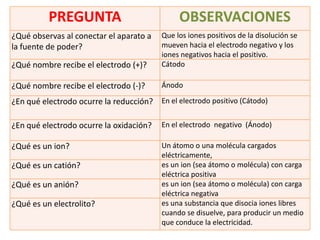
(1) Este documento describe un experimento de electrólisis de una solución de yoduro de potasio. (2) Durante la electrólisis, los iones de potasio se reducen en el cátodo formando hidróxido de potasio y los iones de yodo se oxidan en el ánodo formando yodo elemental. (3) El objetivo es observar cómo la sal inorgánica de yoduro de potasio puede ser descompuesta en sus iones a través de la electrólisis.