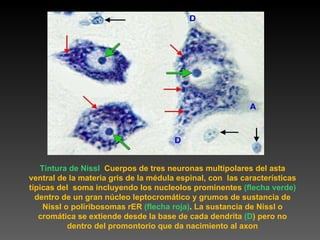
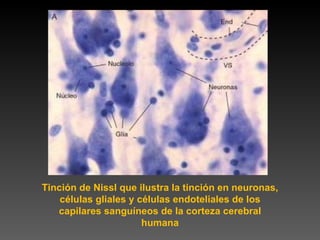
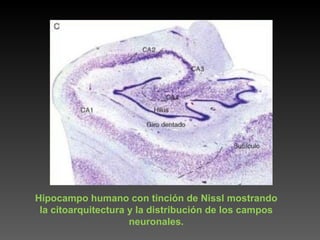
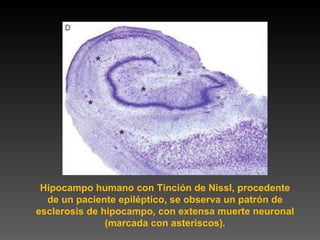
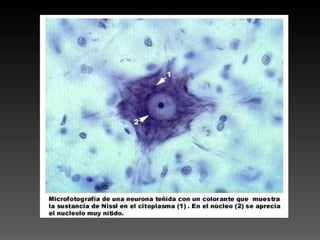
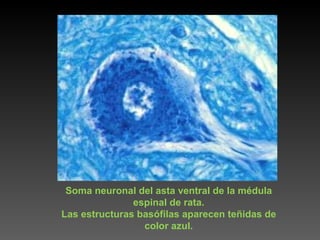
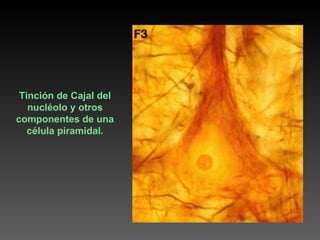
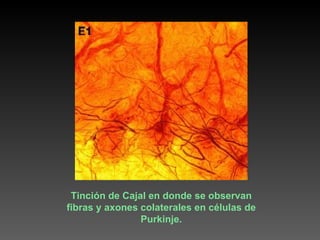
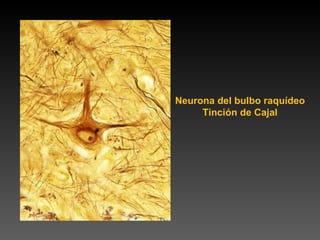
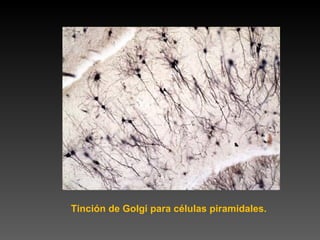
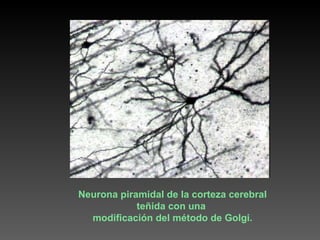
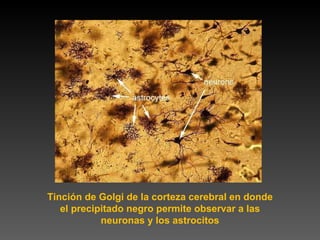
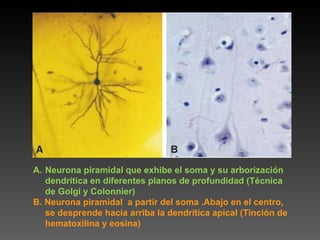
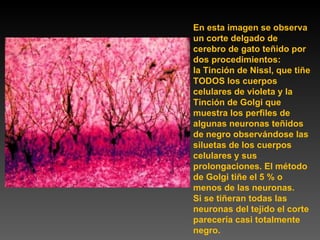
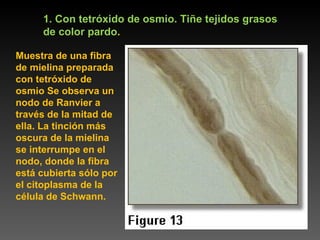
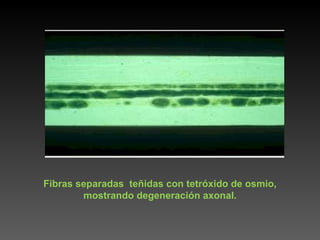
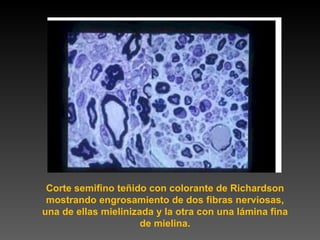
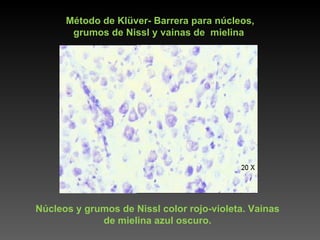
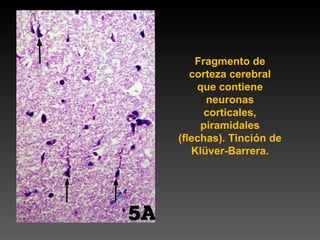
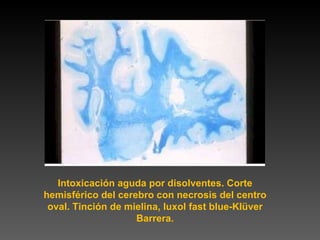
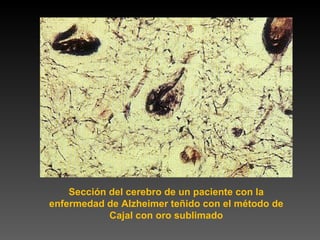
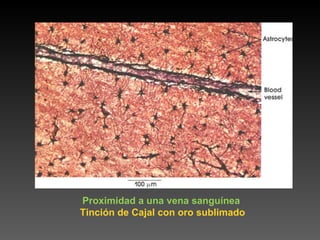
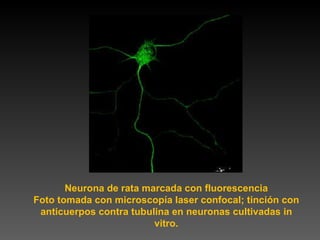
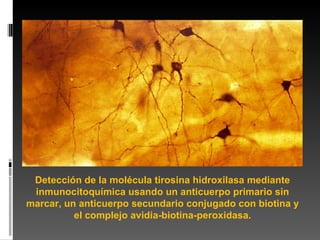
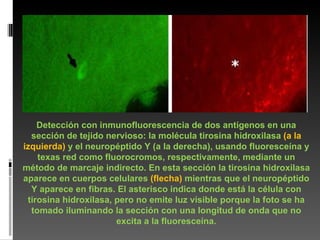
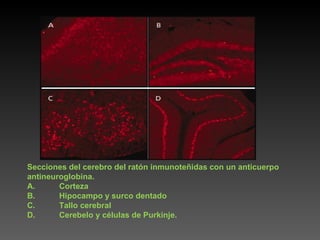
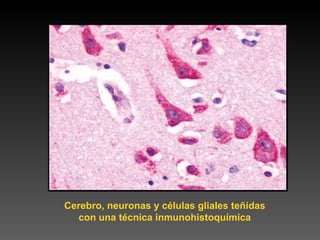
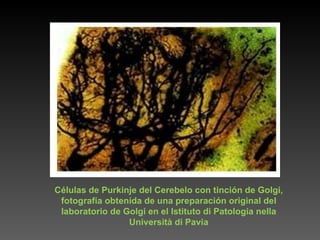
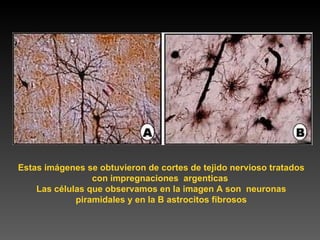
Este documento describe diferentes técnicas de tinción e inmunomarcaje utilizadas para analizar tejido nervioso obtenido de muestras de cerebro y médula espinal. Incluye descripciones de técnicas de tinción como tinción de Nissl, Golgi, Klüver-Barrera e inmunocitoquímica, las cuales permiten visualizar estructuras celulares como neuronas, axones, dendritas, mielina y marcadores neuroquímicos. También presenta imágenes ilustrativas de tejido