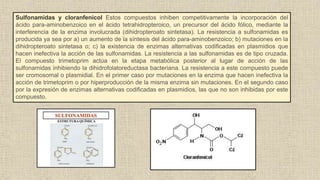
La resistencia bacteriana a los antibióticos se debe a diversos mecanismos como la modificación enzimática del antibiótico, cambios en la permeabilidad bacteriana, y modificaciones en el sitio de acción del antibiótico. Estos mecanismos incluyen la producción de enzimas como las beta-lactamasas y enzimas modificadoras de aminoglucósidos, así como mutaciones que alteran las porinas o el ADN girasa bacterianos. La resistencia es un problema creciente que limita el tratamiento de infecciones.