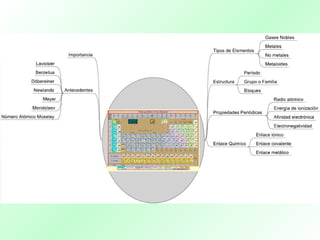
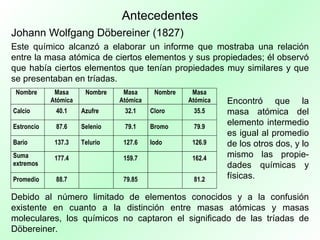
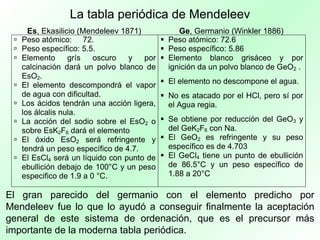
La tabla periódica organiza los elementos químicos según sus propiedades y configuraciones electrónicas, siendo crucial para el estudio de la química. A lo largo de la historia, diversos científicos, como Lavoisier y Mendeleev, aportaron al desarrollo y comprensión de esta herramienta, que permite predecir propiedades de los elementos. La evolución del concepto de número atómico por Moseley mejoró la precisión de la tabla, consolidándola como un recurso esencial en la química moderna.