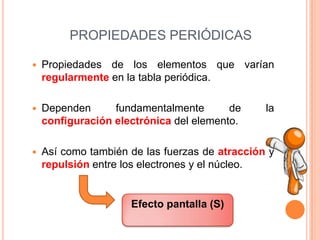
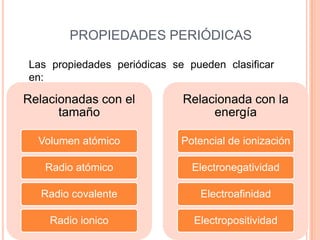
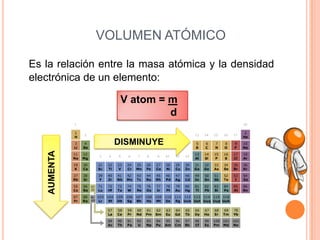
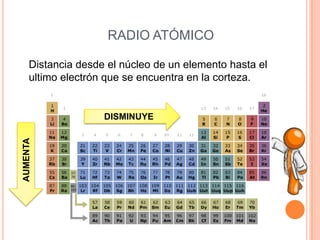
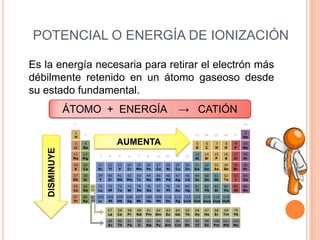
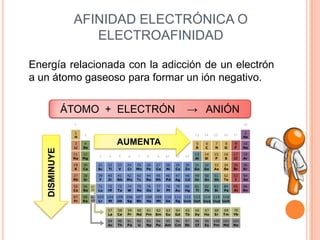
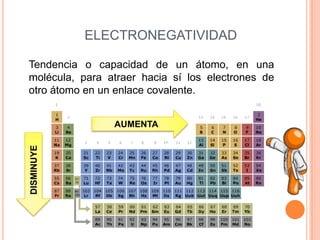
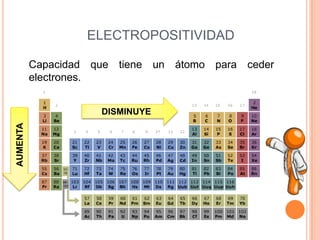
Este documento describe las propiedades periódicas de los elementos químicos. Explica que estas propiedades varían sistemáticamente en la tabla periódica y dependen de la configuración electrónica y las fuerzas de atracción entre electrones y núcleo de cada elemento. Enumera algunas propiedades periódicas comunes como el volumen atómico, radio atómico, potencial de ionización, afinidad electrónica y electronegatividad, y cómo estas propiedades tienden a aumentar o disminuir a lo largo de la tabla per