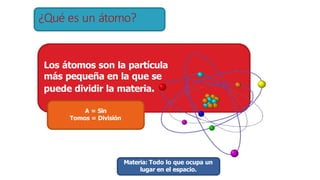
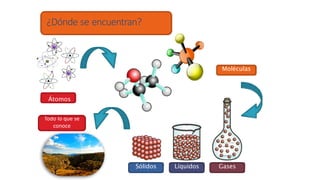
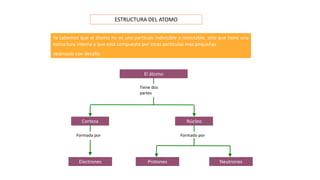
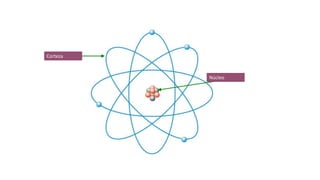
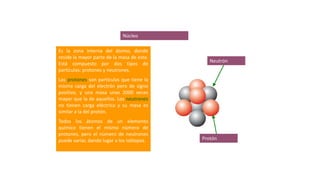
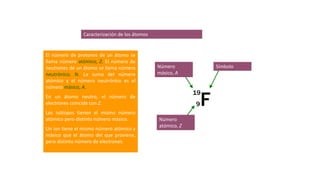
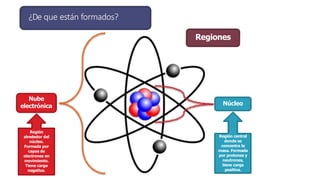
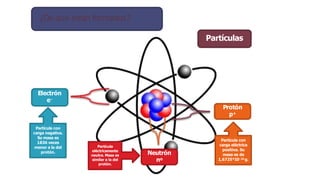
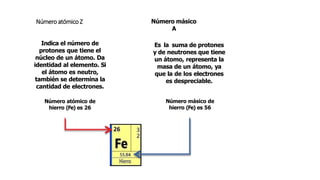
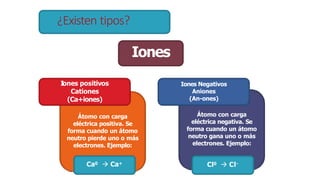
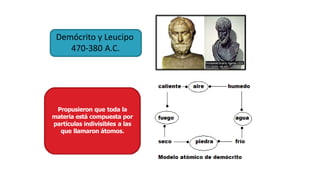
Los átomos son la partícula más pequeña en la que se puede dividir la materia. Están formados por un núcleo central compuesto de protones y neutrones, rodeado por electrones. Todos los átomos de un elemento tienen el mismo número de protones pero pueden variar en el número de neutrones, formando isótopos. Los átomos se unen en proporciones fijas para formar compuestos químicos.