Incrustar presentación
Descargado 110 veces






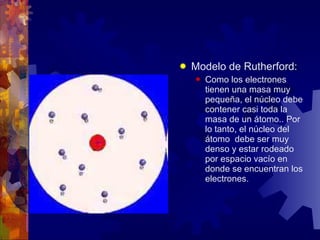
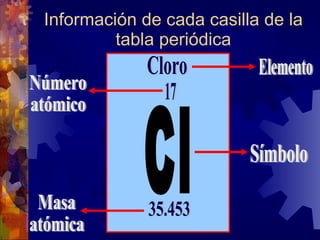


El documento describe la historia y estructura del átomo. John Dalton propuso la teoría atómica en 1803, la cual establece que toda la materia está compuesta de átomos indivisibles y que los átomos de un mismo elemento son iguales entre sí pero diferentes a los de otros elementos. Los modelos de Thomson, Nagaoka y Rutherford intentaron explicar la estructura del átomo, concluyendo que consiste de un núcleo denso rodeado por electrones. El núcleo contiene protones con carga positiva y neutrones sin carga, mientras









