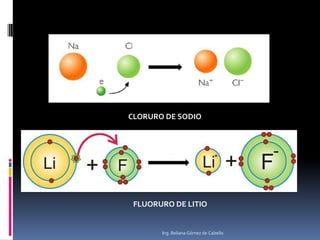
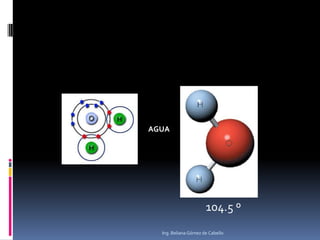
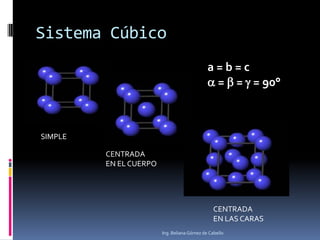
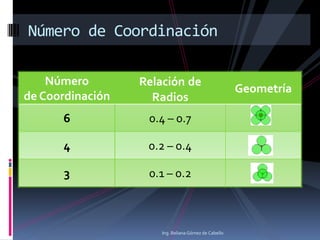
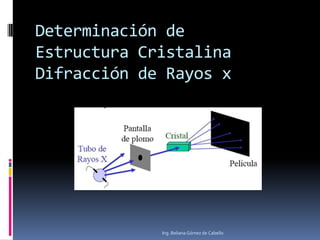
El documento describe la estructura atómica y los diferentes modelos del átomo, incluyendo el modelo de Bohr, el modelo cuántico de Schrödinger y los orbitales atómicos. También explica los diferentes tipos de enlaces como iónico, covalente y metálico, y la estructura cristalina de los materiales, con definiciones de parámetros de red, sistemas cristalinos, celdas unitarias y difracción de rayos X.