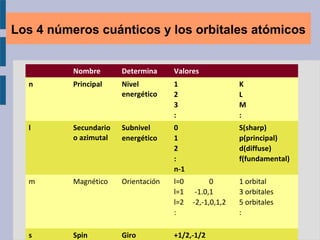
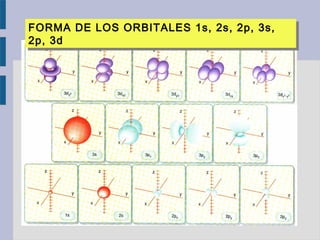
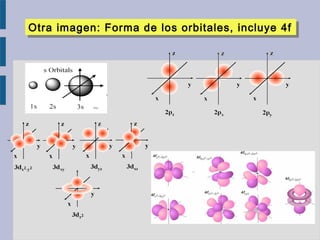
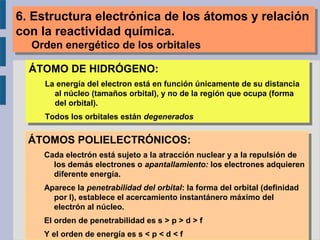
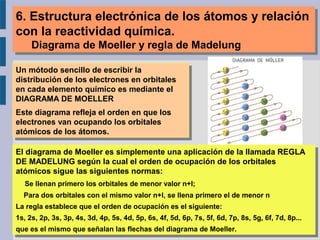
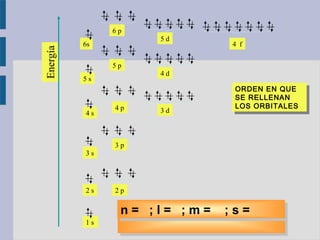
Este documento trata sobre la estructura atómica de la materia y el sistema periódico de los elementos. Explica el modelo atómico actual basado en la mecánica cuántica, incluyendo la función de onda de Schrödinger, los números cuánticos y los orbitales atómicos. También describe la estructura electrónica de los átomos y su relación con la reactividad química, como el orden energético de los orbitales y la configuración electrónica de los elementos.












![EJEMPLOSEJEMPLOS
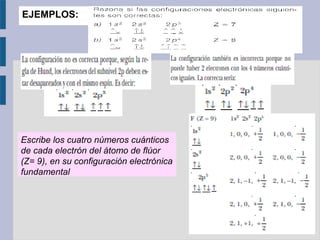
Escribir la estructura electrónica del P (Z=15)
aplicando la regla de máxima multiplicidad de Hund
P es: 1s2
2s2
2p6
3s2
3p3
(3px
1
3py
1
3pz
1
)
Escribir la estructura electrónica del Sc (Z=21)
mediante la configuración abreviada interna del gas
noble
Sc: [Ar]4s2
3d1
Escribir la estructura electrónica del Sc (Z=21)
mediante la configuración abreviada interna del gas
noble
Sc: [Ar]4s2
3d1](https://image.slidesharecdn.com/presentacionestructuramateriaparte2-150405073736-conversion-gate01/85/Presentacion-estructura-materia_parte2-20-320.jpg)