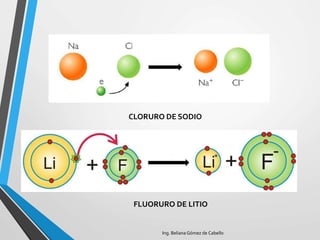
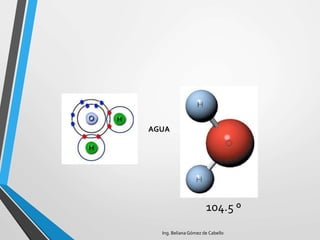
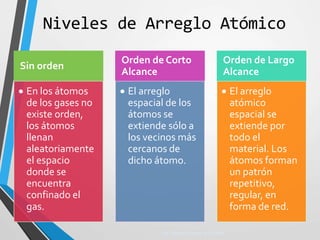
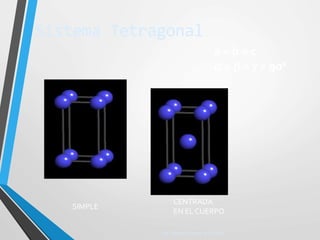
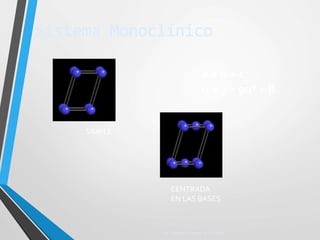
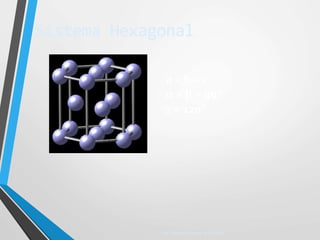
El documento describe la estructura atómica y los tipos de enlaces entre átomos. Explica que los átomos están formados por protones, neutrones y electrones, y que existen diferentes modelos para describir la estructura electrónica de los átomos como el modelo de Bohr y el modelo cuántico. También describe los diferentes tipos de enlaces como iónico, covalente y metálico que mantienen unidos a los átomos. Finalmente, explica la estructura cristalina de los materiales sólidos a nivel atómic