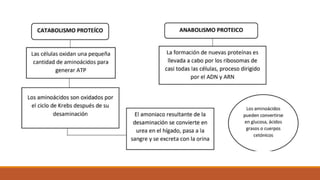
Este documento presenta información sobre las proteínas. En resumen:
1) Las proteínas son macromoléculas compuestas por cadenas polipeptídicas que se pliegan en una forma tridimensional característica. 2) Adquieren estructura primaria, secundaria, terciaria y cuaternaria. 3) Cumplen funciones estructurales, enzimáticas, de transporte y almacenamiento, entre otras, en los seres vivos.