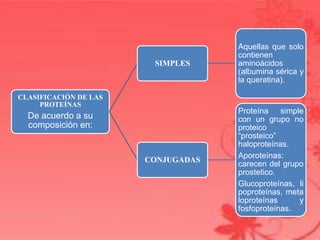
Este documento describe las proteínas, incluyendo que están compuestas principalmente de carbono, hidrógeno, oxígeno y nitrógeno. Explica que las proteínas están formadas por la unión de aminoácidos y adoptan estructuras primarias, secundarias, terciarias y cuaternarias. También clasifica las proteínas según su forma en fibrosas e globulares y según su composición en simples y conjugadas. Finalmente, resume algunas funciones clave de las proteínas como la catálisis, estructura, def