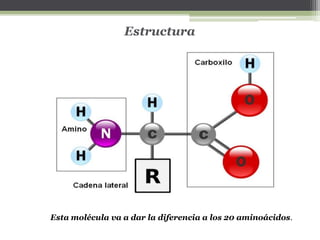
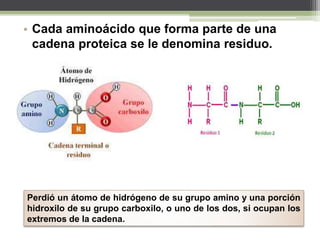
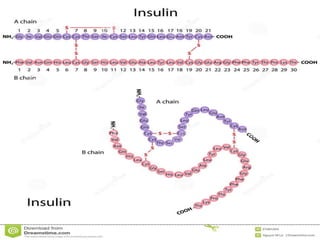
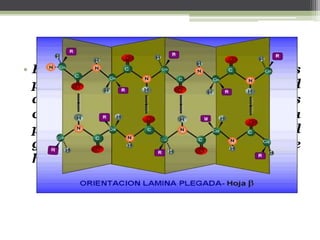
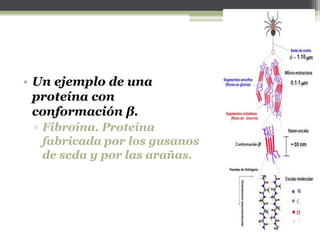
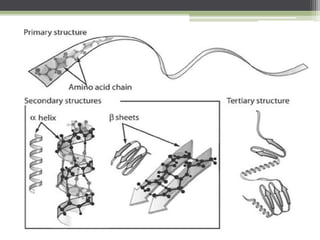
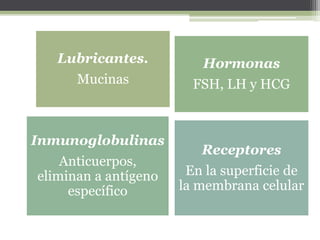
El documento describe las proteínas, incluyendo su composición, estructura y clasificación. Las proteínas son polímeros de aminoácidos que adoptan estructuras cuaternarias, terciarias y secundarias. Se clasifican por su solubilidad, composición y función. Las proteínas cumplen funciones estructurales y funcionales cruciales en las células.