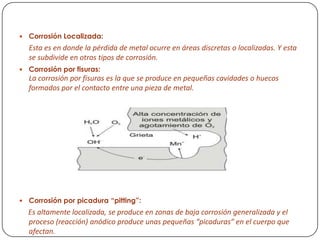
Este documento trata sobre la corrosión. Explica que la corrosión es la acción de agentes naturales como el aire y el agua salada sobre los metales. Describe varios tipos de corrosión como la atmosférica, galvánica y localizada. También menciona factores que favorecen la corrosión como la presencia de oxígeno, sales, humedad y diferencias eléctricas. Finalmente, propone métodos para evitar la corrosión como recubrimientos con zinc, plásticos, pinturas y protección cató