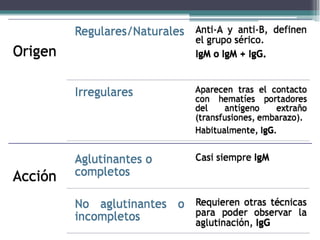
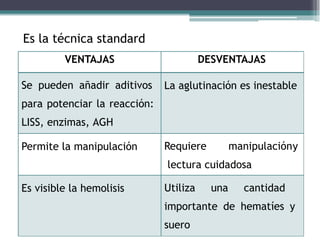
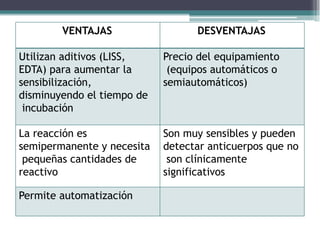
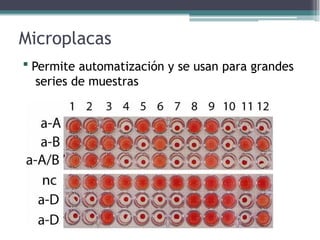
El documento aborda las pruebas de compatibilidad pretransfusionales en medicina, enfatizando la correcta identificación del paciente y la realización precisa de las pruebas necesarias para evitar reacciones adversas. Se describen procedimientos específicos como el estudio de grupos sanguíneos, el escrutinio de anticuerpos irregulares y las pruebas cruzadas, así como diversas técnicas de aglutinación. Se concluye que la automatización de estas pruebas mejora la eficiencia y la precisión en el laboratorio, aunque no siempre aumenta la seguridad en transfusiones.