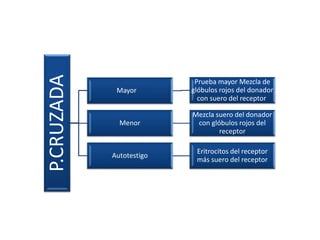
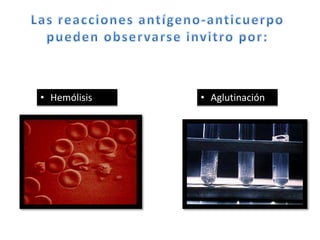
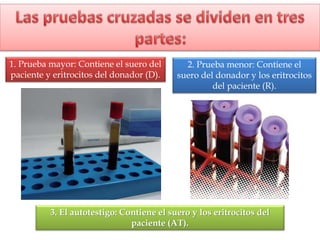
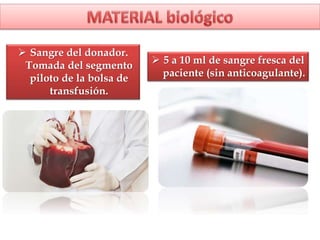
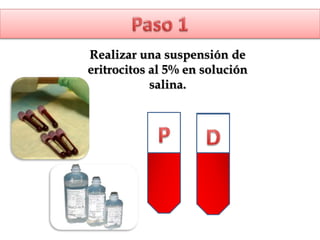
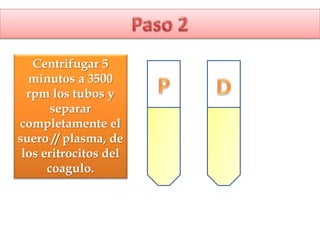
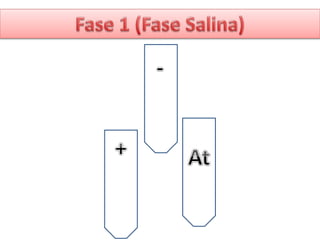
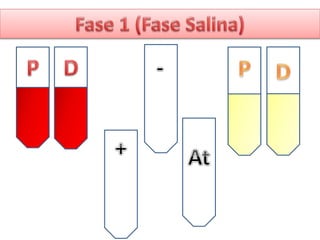
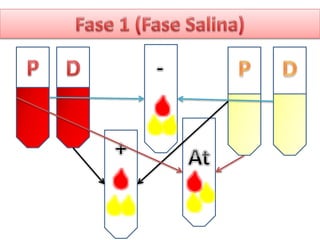
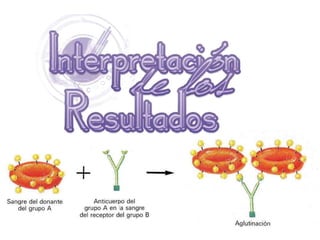
1) Las pruebas cruzadas permiten determinar la compatibilidad entre la sangre del donante y el receptor mediante la mezcla de sus glóbulos rojos y suero. 2) Esto ayuda a prevenir reacciones transfusionales al detectar cualquier anticuerpo presente en el suero del receptor. 3) Siguiendo procedimientos estandarizados, las pruebas cruzadas identifican de forma confiable si la sangre es compatible y segura antes de una transfusión.