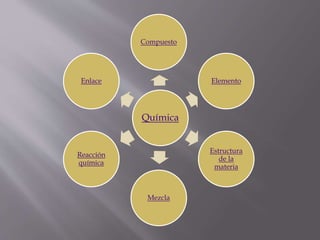
Este documento proporciona información sobre conceptos básicos de química como elementos, átomos, moléculas, compuestos, enlaces y reacciones químicas. Explica los principales tipos de compuestos inorgánicos como óxidos, hidruros e hidróxidos y los principales compuestos orgánicos como alifáticos y aromáticos. También define los estados de la materia sólido, líquido y gaseoso, y describe la estructura del átomo y sus partículas subatómic