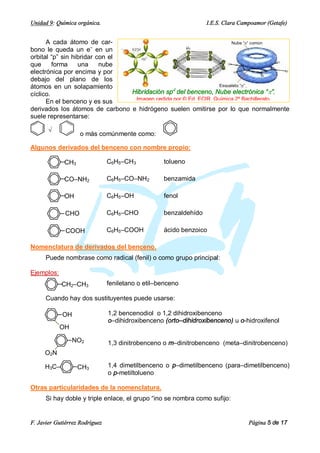
Este documento presenta los contenidos de la unidad 9 de química orgánica. Cubre las características del carbono, la formulación y nomenclatura de compuestos orgánicos con dos grupos funcionales, la reactividad de compuestos orgánicos a través de desplazamientos electrónicos e intermedios de reacción, y los principales tipos de reacciones orgánicas como sustitución, adición, eliminación y oxidación-reducción. También explica la hibridación del carbono, tipos de enlace, y nomencl