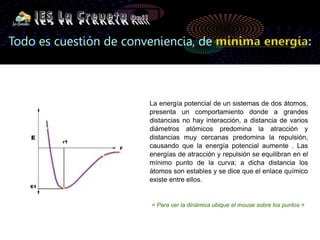
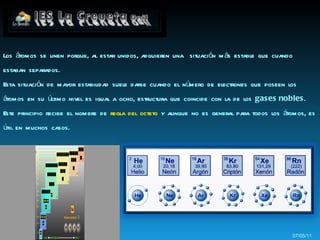
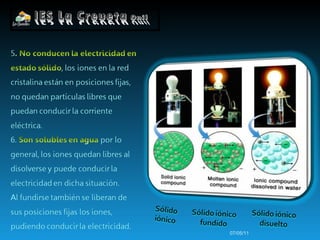
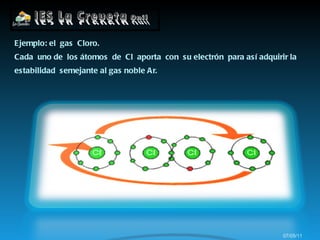
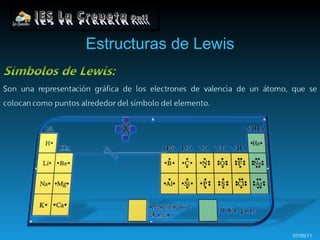
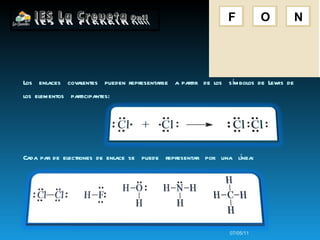
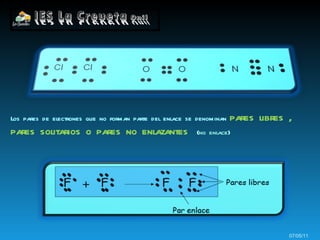
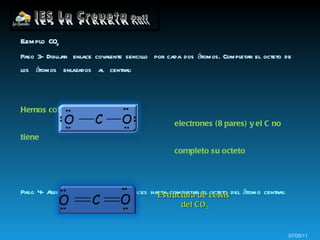
Los átomos se unen formando enlaces químicos para alcanzar una configuración más estable similar a los gases nobles. Los átomos pueden intercambiar electrones formando iones positivos y negativos unidos por fuerzas electrostáticas, o compartir electrones formando enlaces covalentes.