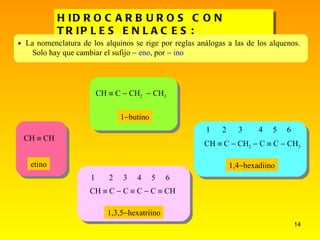
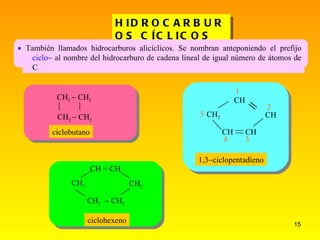
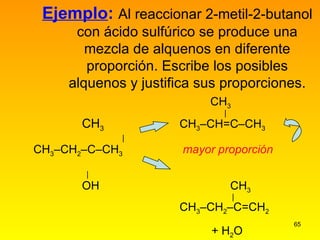
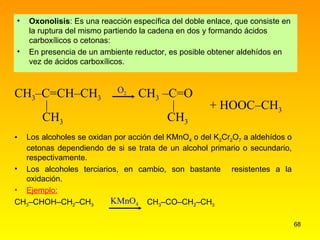
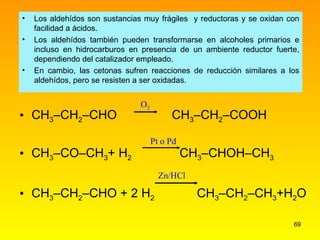
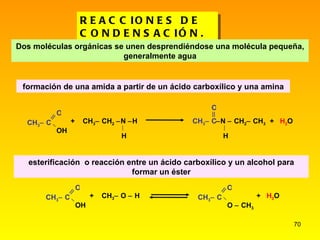
El documento describe las características del carbono y su capacidad para formar enlaces covalentes simples, dobles y triples. Explica los diferentes tipos de hibridación del carbono (sp3, sp2, sp) y cómo esto determina la geometría molecular. También clasifica los hidrocarburos en saturados e insaturados y describe su nomenclatura sistemática.