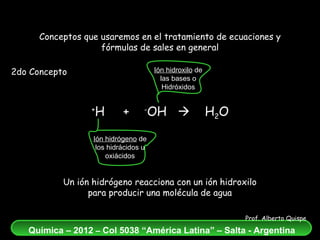
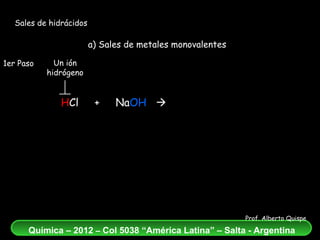
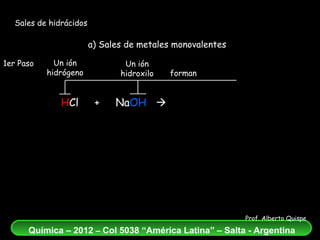
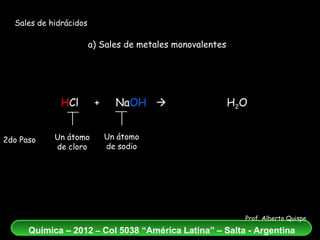
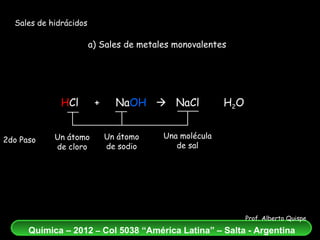
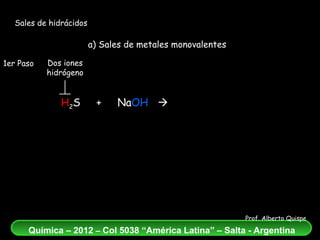
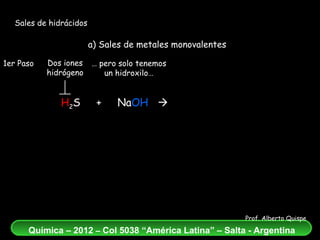
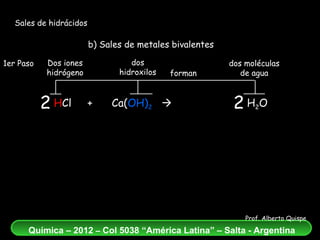
El documento aborda la formación de sales de hidrácidos a partir de reacciones entre ácidos y bases, explicando los conceptos de estos procesos químicos. Se presentan ejemplos de reacciones entre diferentes hidrácidos y metales, destacando la correcta nomenclatura de las sales resultantes. Además, se enfatiza la importancia del balance atómico en las ecuaciones químicas de neutralización.