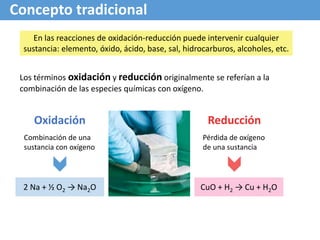
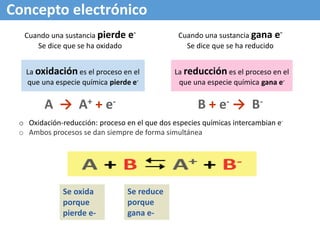
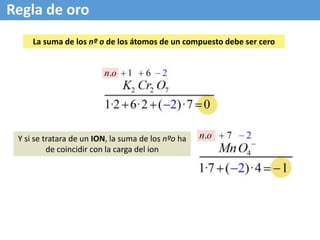
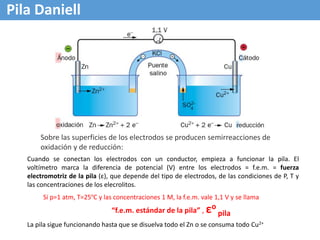
El documento describe conceptos tradicionales y electrónicos de las reacciones de oxidación-reducción. Tradicionalmente, se referían a la combinación con oxígeno, pero el concepto electrónico se refiere al intercambio de electrones, donde la oxidación implica la pérdida de electrones y la reducción la ganancia de electrones. Las reacciones redox siempre involucran la oxidación simultánea y reducción de especies químicas a través del intercambio de electrones.