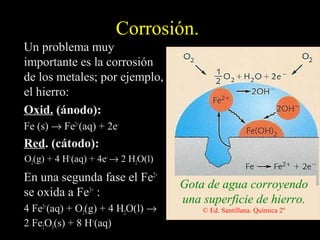
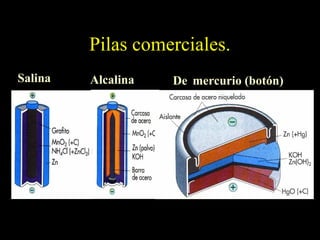
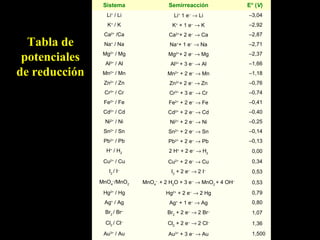
Este documento resume las reacciones de transferencia de electrones (reacciones redox). Explica conceptos como oxidación, reducción, números de oxidación y cómo ajustar ecuaciones redox. También cubre temas como pilas electroquímicas, potenciales estándar de reducción y aplicaciones industriales de reacciones redox como la electrólisis y la producción de metales.


























![Valoración redox
Es similar a la valoración ácido base.
Hay que determinar el número de moles de especie
oxidante y reductora que reaccionan entre sí.
El nº de moles de e− que pierde el oxidante es igual a
los que gana el reductor.
Si “a” es el nº de e− que captura el oxidante y “b” los
que pierde el reductor, sabremos que “a” moles de
reductor reaccionan con “b” moles de oxidante.
Vox ×[oxidante ]× b ( nº e- perd) = Vred ×[reductor ]× a (nº e- gan.)
Se necesita conocer qué especies químicas son los
productos y no sólo los reactivos.](https://image.slidesharecdn.com/redoxpresentacin-130318195929-phpapp01/85/Redox-presentacion-28-320.jpg)







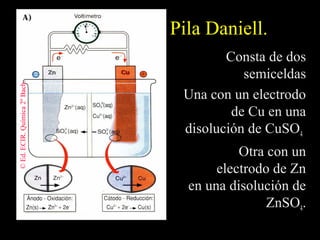
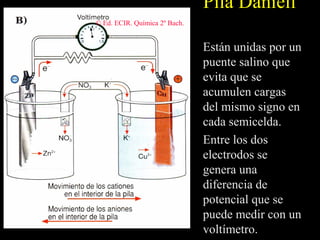



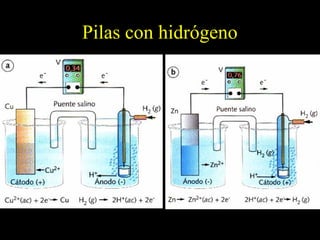
![Electrodos de Hidrógeno.
Al potencial de reducción del electrodo de
hidrógeno se le asigna por convenio un
potencial de 0’0 V para [H+] = 1 M.
Reac. de reducción: 2 H+ + 2 e– → H2
Un electrodo de hidrógeno es una lámina de
platino sobre el que se burbujea H2 a una
presión de 1 atm a través de una disolución
1 M de H+.](https://image.slidesharecdn.com/redoxpresentacin-130318195929-phpapp01/85/Redox-presentacion-42-320.jpg)
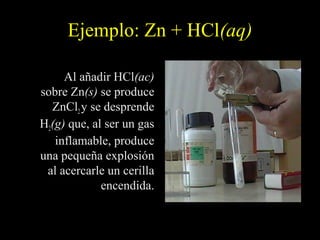
![Metales frente a ácidos.
Según sea el potencial de reducción del metal menor o
mayor que 0 reaccionará o no reaccionará con los
ácidos para [H+] = 1 M.
Toda pareja oxidante-reductora que tenga más
tendencia a reducirse que los H+ tendrán un potencial
de reducción E > 0.
– Así, el Cu no reacciona con ácidos en concentraciones
normales: Cu + 2 H+ → no reacciona.
Toda pareja oxidante-reductora que tenga menos
tendencia a reducirse que los H+ tendrán un potencial
de reducción E < 0.
– Así, el Zn reacciona con ácidos desprendiendo hidrógeno:
Zn + 2 H+ → Zn2+ + H2](https://image.slidesharecdn.com/redoxpresentacin-130318195929-phpapp01/85/Redox-presentacion-44-320.jpg)