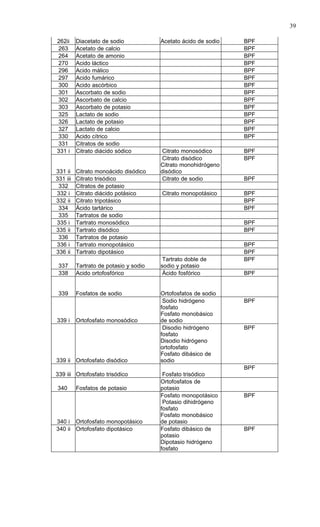
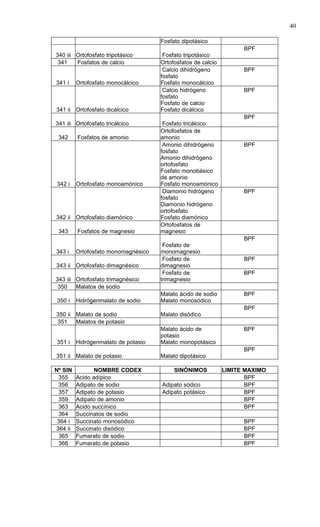
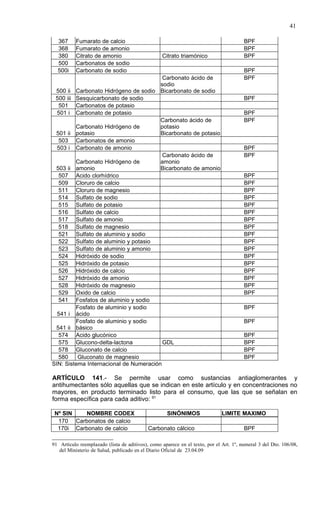
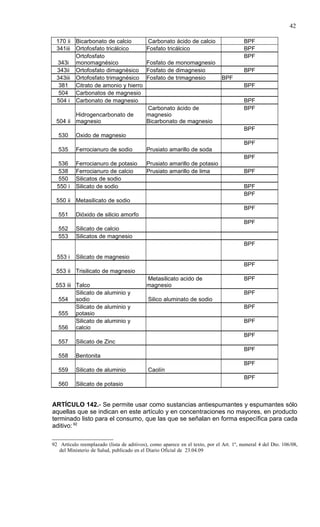
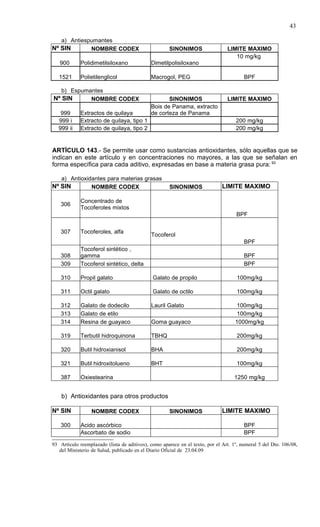
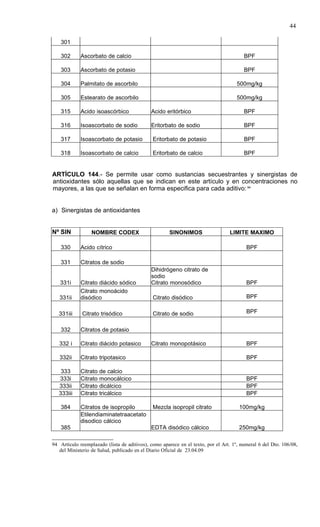
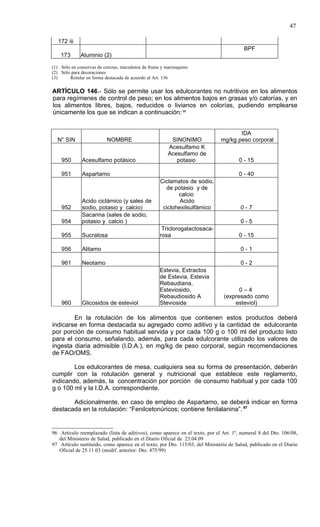
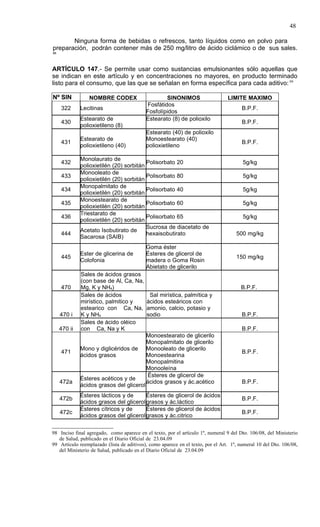
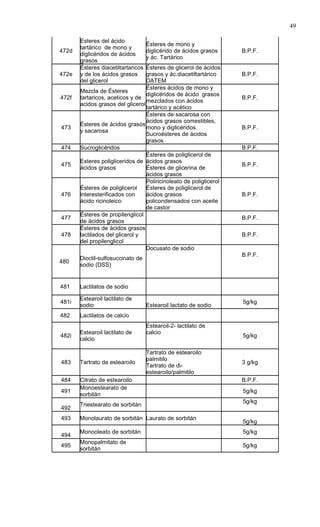
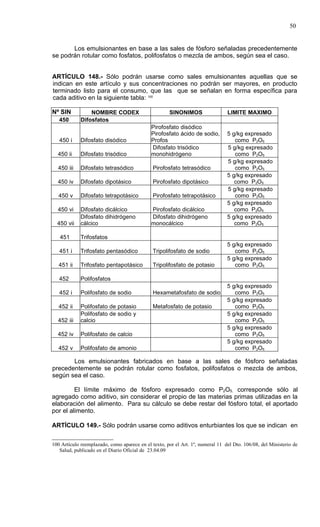
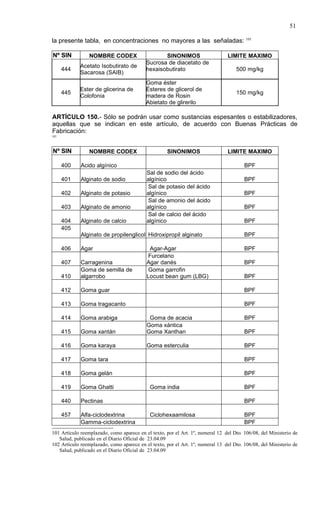
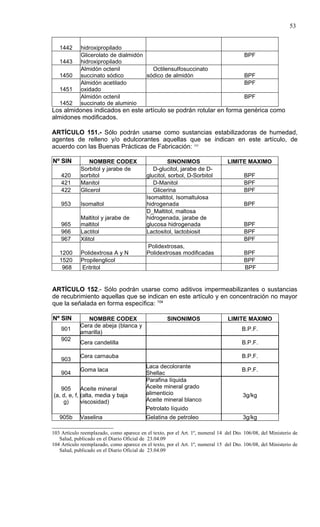
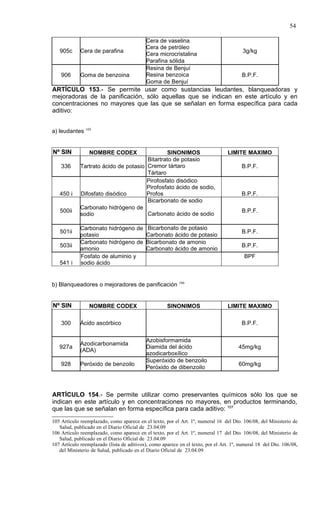
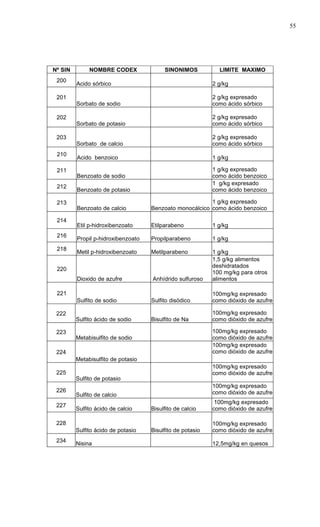
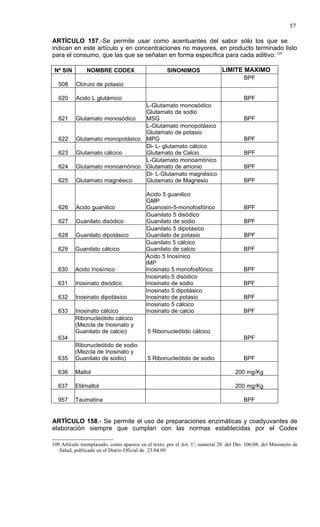
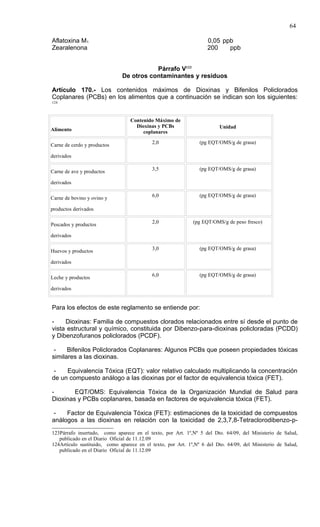
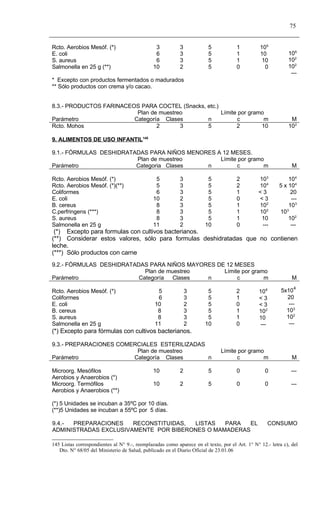
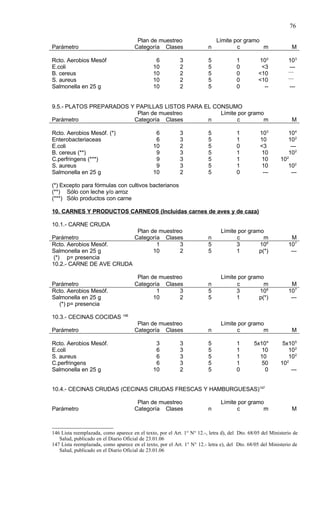
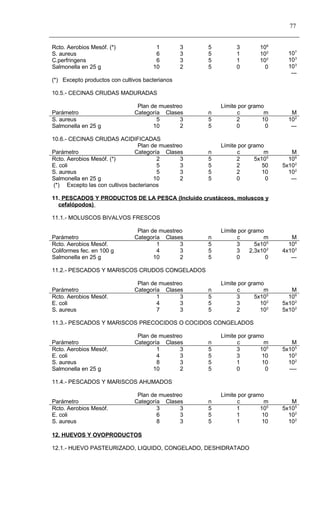
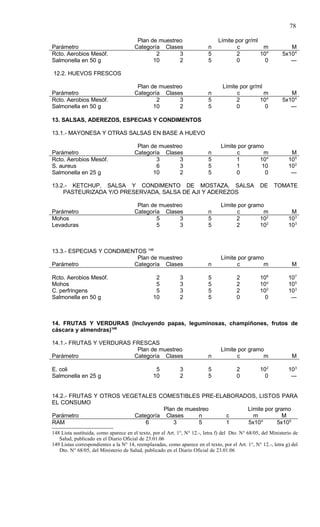
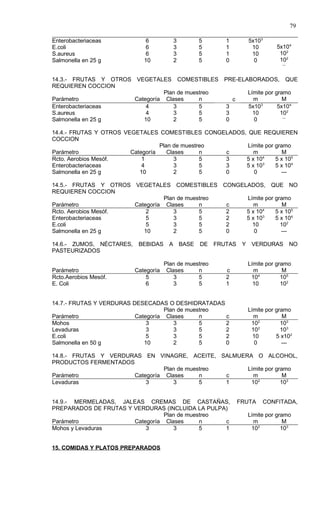
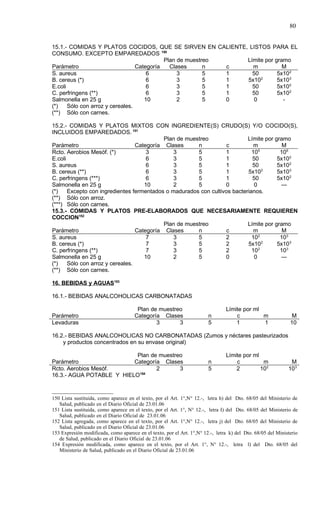
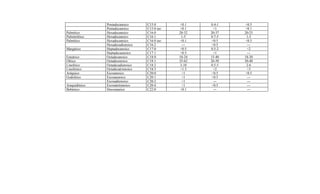
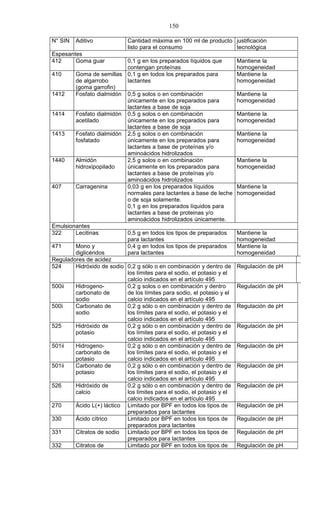
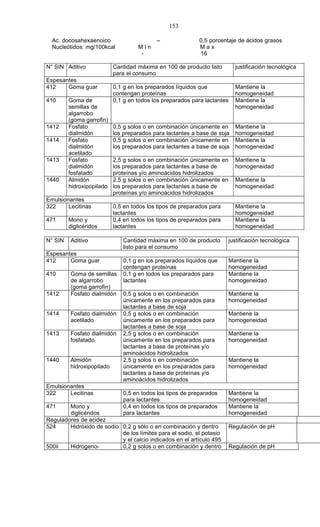
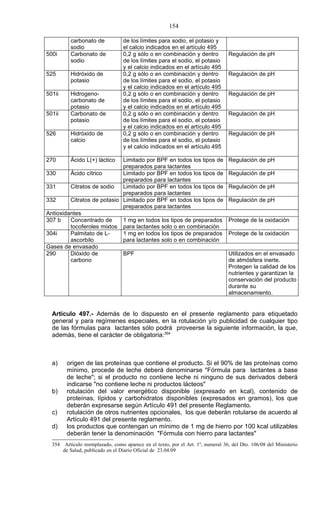
Este documento presenta el Reglamento Sanitario de los Alimentos de Chile, incluyendo 23 títulos que cubren diversos temas relacionados con la higiene y seguridad de los alimentos. Se han realizado numerosas modificaciones a lo largo de los años para actualizar el reglamento. El índice enumera los artículos incluidos en cada título sobre principios de higiene, alimentos específicos, aditivos, contaminantes y más.