Este documento describe el aislamiento e identificación estructural del cucumariosido A8, un intermediario metabólico del pepino de mar Eupentacta fraudatrix. El cucumariosido A8 es un 3β-O-glicosilado-16β-acetoxi-9β-H-lanosta-7,24-dieno-3β,18,20β-triol que proporciona nueva información sobre la biosíntesis de los glicósidos de trimetilesterol en pepinos de mar.








![Extracción y aislamiento
Extracción Concentrados a
Picado por reflujo sequedad y cromatografiados
s (x2) EtOH redisueltos en en columna de
70% H2O Polychrom-1
PTseco=650
g
Fracción de glicósidos Sales inorganicas
crudos con 60% e impurezas
acetona (15 g) polares con H2O
Sub-Fracción A
Separada por HPLC en
columna Discovery C-18 Cromatografía en columna de Si gel
(10 250 mm) con 83% column
MeOH 5mg de [CHCl3/EtOH/H2O (100:100:17)] 650
cucumariosido A8 mg](https://image.slidesharecdn.com/seminario3-121110175614-phpapp01/85/Seminario-3-11-320.jpg)

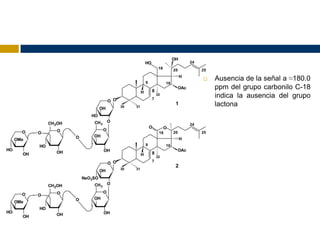
![ Cucumarioside A8
Fórmula: C55H90O22
HR MALDI TOF MS (þ) m/z 1125.5812 (calc 1125.5816) [M þ
Na]þ.
3 β -O-[3-O-metil-β-D-xilopiranosil-(1/3)-b-D-
glucopyranosyl-(1/4)-b-D-quinovopiranosil-(1/2)-β-D-
xilopiranosil]-16β acetoxi-9β-H-lanosta-7,24-dieno-
18,20β-diol](https://image.slidesharecdn.com/seminario3-121110175614-phpapp01/85/Seminario-3-13-320.jpg)
![ 7(8)doble enlace (122.8 (C-7)
y 147.5 (C-8) ppm en el 13C
RMN
Grupo16β-acetoxido [señales
a 76.7 ppm (C-16) y 5.88
(td, J ¼ 7.9, 5.4) ppm (H-16)
en el espectro de 13C y 1H
RMN, respectivamente; 169.9
y 21.2 ppm y 2.13 ppm (OAc)
en el espectro de 13C y 1H
RMN
La configuración 9β -H
[señales a 2.54 (brd, J ¼
13.9) ppm (H-9) y 24.4 ppm
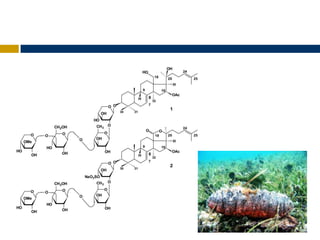
Cucumariosides A8 (1) y G1 (2) de Eupentacta
(C-19)]
fraudatrix.](https://image.slidesharecdn.com/seminario3-121110175614-phpapp01/85/Seminario-3-14-320.jpg)