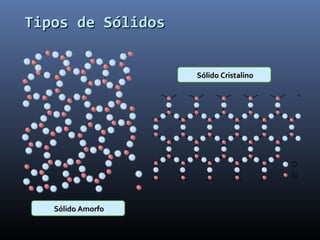
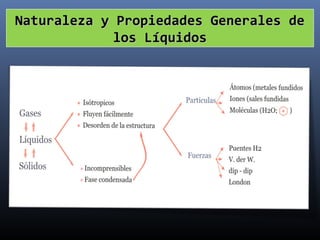
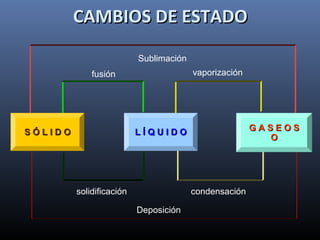
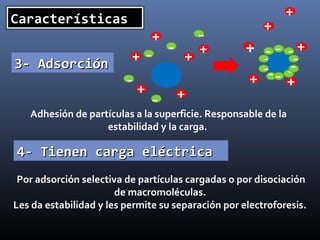
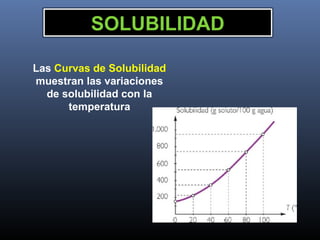
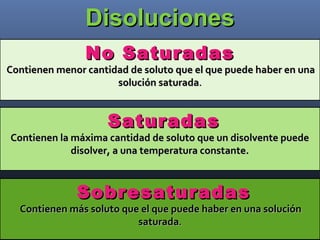
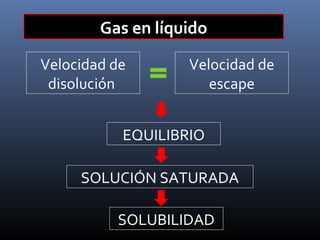
Este documento trata sobre los estados de la materia y las propiedades de sólidos, líquidos y gases. Explica que los sólidos tienen una estructura interna ordenada y no fluyen, mientras que los líquidos adquieren la forma de su recipiente y los gases no tienen forma definida. También describe sistemas dispersos como soluciones, coloides y emulsiones, así como conceptos como concentración, solubilidad y diferentes tipos de disoluciones.