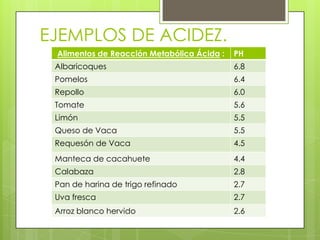
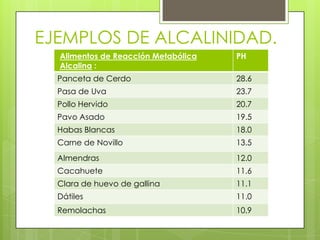
Este documento proporciona definiciones y explicaciones sobre varios temas fundamentales de ingeniería ambiental, incluyendo el significado de términos como suspensión, solución, soluto y solvente. También explica cómo expresar la concentración de soluciones a través de normalidad, molaridad y otras unidades. Además, describe el pH y la escala de acidez y alcalinidad, y presenta la ley de Henry sobre la solubilidad de gases en líquidos.


















![EL POTENCIAL DEL
HIDROGENO ASOCIADO A LAS
SOLUCIONES: PH.
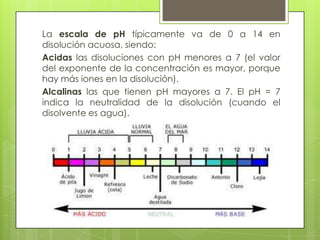
El pH (potencial de hidrógeno) es una medida
de acidez o alcalinidad de una disolución.
El pH indica la concentración de iones hidronio
[H3O+] presentes en determinadas sustancias.
La sigla significa "potencial de hidrógeno". Este
término fue acuñado por el químico danés
Sørensen, quien lo definió como el logaritmo
negativo en base 10 de la actividad de los
iones hidrógeno. Esto es:](https://image.slidesharecdn.com/ingenieriaambiental-120927104536-phpapp01/85/Ingenieria-ambiental-20-320.jpg)


![Ejemplo: ion Hidronio [H3O+]
Una concentración de [H3O+] = 1 × 10–7 M
(0,0000001) es simplemente un pH de 7 ya que:
pH = –log[10–7] = 7](https://image.slidesharecdn.com/ingenieriaambiental-120927104536-phpapp01/85/Ingenieria-ambiental-24-320.jpg)