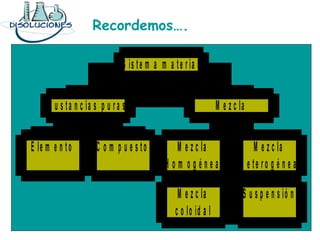
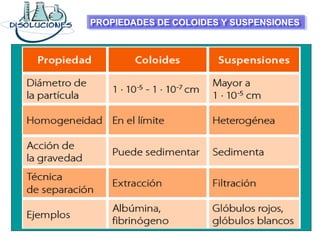
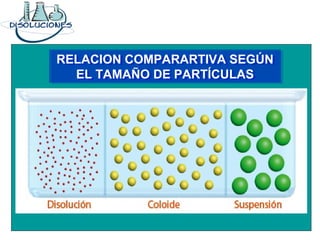
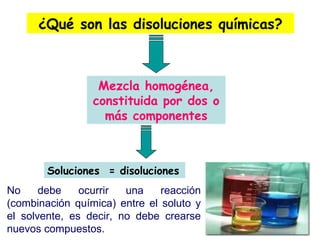
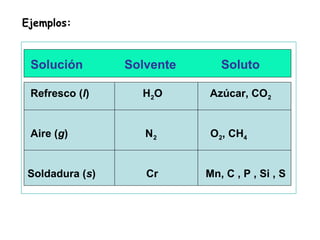
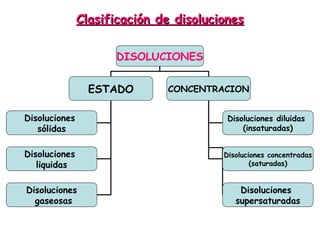
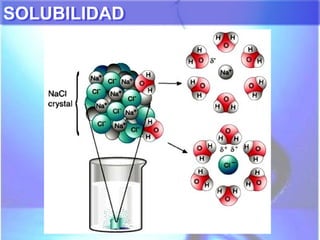
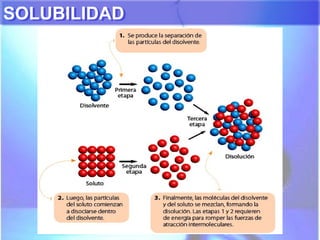
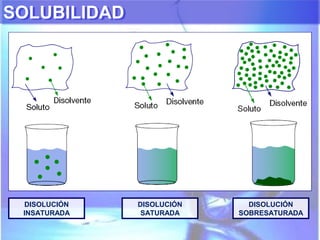
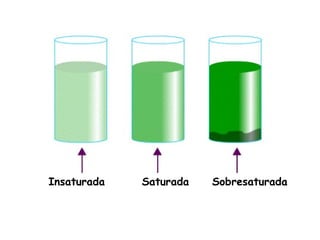
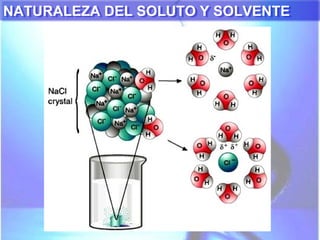
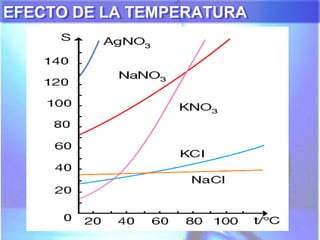
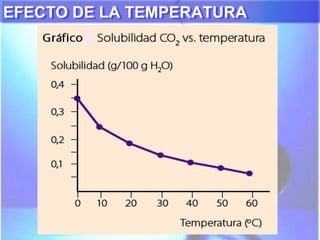
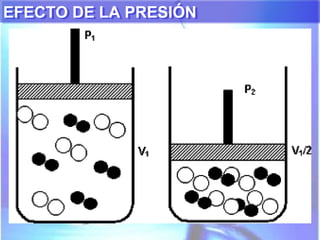
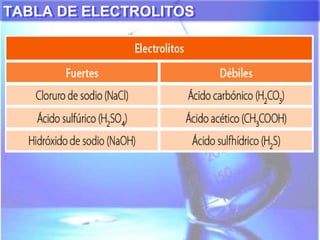
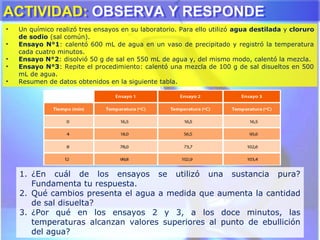
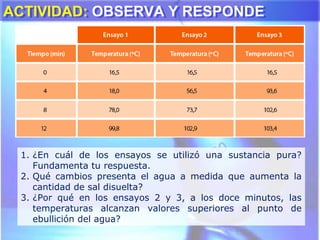
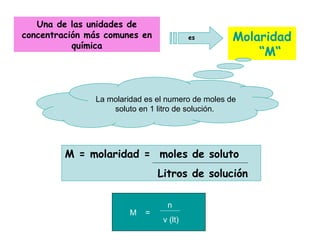
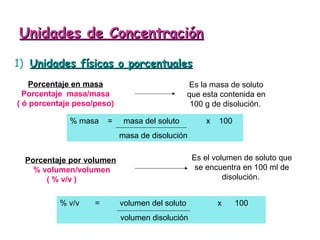
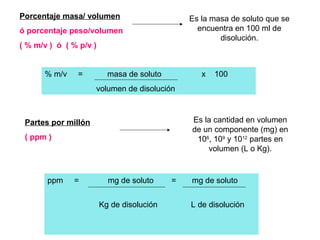
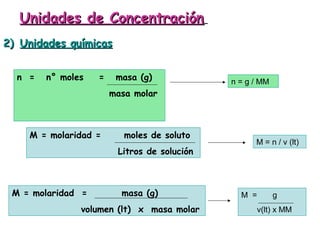
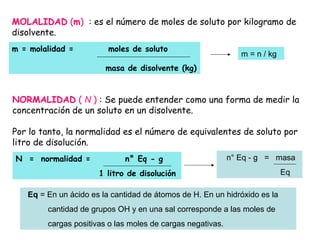
El documento explica los conceptos fundamentales de disoluciones químicas, diferenciando entre sustancias puras, elementos, compuestos y mezclas. Además, detalla las características de mezclas homogéneas, heterogéneas, coloides y suspensiones, así como la clasificación y factores que afectan la solubilidad. También se abordan unidades de concentración y la importancia del agua como disolvente universal.