DISOLUCIONES QUÍMICAS 1.pdf
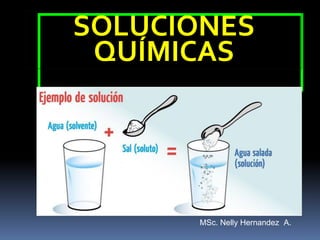
- 3. Una Solución: Es un sistema material homogéneo formado por dos o más sustancias. ss. La sustancia menos abundante recibe el nombre de SOLUTO y la más abundante el nombre de SOLVENTE. Solución = Soluto + Solvente
- 4. Formados por: Soluto Se halla en menor proporción. Solvente Se halla en mayor proporción. + Agua salada Disoluciones
- 5. El agua: sEs descrita muchas veces como el solvente universal, porque disuelve muchas de las sustancias conocidas. Al disolver un soluto en agua las moléculas de agua rodean al soluto tal como muestra la siguiente figura.
- 6. disolución de sal en agua
- 7. CLASIFICACIÓN DE LAS SOLUCIONES A) SEGÚN EL ESTADO FÍSICO: sólidas, líquidas y gaseosas B) SEGÚN LA CANTIDAD DE SOLUTO: Diluidas, concentradas, saturadas y sobresaturadas.
- 8. SOLUCIÓN SÓLIDO - SÓLIDO: Ejm. Acero: C en Fe Bronce: Sn en Cu
- 9. SOLUCIÓN SÓLIDO –LÍQUIDO Ejm AMALGAMA DENTAL Hg en Ag
- 10. SOLUCIÓN DE SÓLIDO EN GAS Ejm ▪ Hidrógeno en Pd: ( Oclusión)
- 11. Ejm. LÍQUIDO - SÓLIDO ▪ NaCl en agua
- 12. LÍQUIDO – LÍQUIDO Ejm. ▪ Alcohol en agua
- 13. LÍQUIDA –GAS : Ejm. ▪ AGUA GASEOSA. Dióxido de carbono en agua
- 14. Gas-sólido: Ejm. ▪ Naftalina en el aire
- 15. Gas- líquido: Ejm. ▪ Agua en aire ( Aire húmedo)
- 16. GAS-GAS: Ejm. GLP ▪ AIRE QUE RESPIRAMOS: Oxígeno en Nitrógeno
- 17. Concentración Concentración FÍSICAS Se refiere a la cantidad de soluto que hay en una determinada cantidad de solvente o solución. QUÍMICAS Se expresa en unidades:
- 18. UNIDADES FÍSICAS PORCENTAJE MASA /MASA ( %m/m) UNIDADES QUÍMICAS MOLALIDAD (m) FRACCIÓN MOLAR (X) PORCENTAJE MASA / VOL. (%m/v) PORCENTAJE VOL. / VOL. (%v/v) MOLARIDAD (M) NORMALIDAD (N)
- 19. UNIDADES FÍSICAS PORCENTAJE masa - masa %m/m “Masa en gramos de soluto por cada 100 gramos de solución.” % m/m = Masa de soluto (g) x 100% Masa de solución (g) Por ejemplo: Na (OH) al 10% contendrá 10 gramos del hidróxido por cada 100 gramos de solución.
- 20. UNIDADES FÍSICAS PORCENTAJE MASA - VOL %m / v “Masa en gramos de soluto por cada 100 mL de solución.” % m/v = Masa de soluto (g) x100% Volumen de solución (ml) Por ejemplo: CaCl2 al 5% P/V contendrá 5 gramos de la sal por cada 100 mL de solución.
- 21. UNIDADES FÍSICAS PORCENTAJE VOL EN VOL %V/V “Volumen de soluto por cada 100 mL de solución.” % V/V = Volumen de soluto (ml) x100% Volumen de solución (ml) Por ejemplo: Etanol al 25% V/V contendrá 25 mL de etanol por cada 100 mL de solución.
- 22. UNIDADES QUÍMICAS MOLARIDAD (M) “Número de moles de soluto por cada litro de solución.” M = moles de soluto Volumen de solución (L) Por ejemplo: NaCl 2 M contendrá 2 moles de NaCl por litro de solución.
- 23. UNIDADES QUÍMICAS MOLALIDAD (m) “Número de moles de soluto por cada kilogramos de solvente.” m = moles de soluto masa del solvente (Kg)
- 24. UNIDADES QUÍMICAS NORMALIDAD (N) “Número de equivalentes-gramo de soluto por cada litro de solución.” N = nº eq-g de soluto Volumen de solución(L) Por ejemplo: HCl 2 N contendrá 2 equivalentes-gramo de HCl por litro de solución.
- 25. UNIDADES QUÍMICAS FRACCIÓN MOLAR (X) “Número de moles del componente A por la suma del número de moles total de la solución.” X = moles de A moles totales
- 26. SOLUBILIDAD Es la cantidad máxima de soluto que puede disolverse en una cantidad dad de solvente, a una Temperatura determinada La solución que se obtiene en estas condiciones se denomina solución saturada La solubilidad se expresa en general en gramos de soluto por 100 gramos de disolvente.
- 27. Concentradas o No Saturadas Contienen menor cantidad de soluto que el que puede haber en una solución saturada. Disoluciones Saturadas Contienen la máxima cantidad de soluto que un disolvente puede disolver, a una temperatura constante. Sobresaturadas Contienen más soluto que el que puede haber en una solución saturada. Diluidas La cantidad de soluto es muy pequeña
- 28. Ejemplo:
- 29. SOLUBILIDAD Sólido en líquido Líquido en líquido Gas en líquido
- 30. Sólido en líquido Los sólidos se disuelven por medio de una DIFUSIÓN del sólido, el cual se rodea de moléculas del disolvente. Factores que favorecen la solubilidad: • El de la superficie del sólido la solubilidad. • La agitación acelera el proceso de disolución. • La presión no modifica mayormente la solubilidad.
- 31. Sólido en líquido Factores que favorecen la solubilidad: • Temperatura (coeficiente térmico de solubilidad). a) Si durante la disolución de un compuesto se absorbe calor (calor de disolución -) Proceso endotérmico ST + SV + CALOR ₌ SN En estos sistemas al la temperatura la solubilidad.
- 32. Sólido en líquido Factores que favorecen la solubilidad: • Temperatura (coeficiente térmico de solubilidad). b) Si durante la disolución de un compuesto se desprende calor (calor de disolución +) Proceso exotérmico ST + SV ₌ SN + CALOR En estos sistemas al la temperatura la solubilidad.
- 33. Líquido en líquido Pueden ocurrir tres casos: • Que sean completamente miscibles ( no existe punto de saturación). • Que sean parcialmente miscibles. (se disuelven hasta un cierto grado y ocurre la saturación). agua + éter etílico. • Que sean inmiscibles.
- 34. Líquido en líquido Factores que favorecen la solubilidad: • T: Al variar la T, varía la solubilidad en diferentes direcciones en líquidos parcialmente miscibles . • P: Al variar la P no se modifica la solubilidad.
- 35. Gas en líquido Velocidad de disolución Velocidad de escape EQUILIBRIO SOLUCIÓN SATURADA SOLUBILIDAD
- 36. Gas en líquido Factores que favorecen la solubilidad: • T: Al la temperatura la solubilidad. “ Debido a que aumenta la energía cinética de las moléculas del gas disueltas y esto favorece que se escapen del líquido.” • P: Al P la solubilidad. “ Debido a que aumenta el número de colisiones del gas con la superficie y aumenta la velocidad de captura.”
- 37. Gas en líquido LEY DE HENRY “LA SOLUBILIDAD DE UN GAS DISUELTO EN UN LÍQUIDO ES PROPORCIONAL A LA PRESIÓN PARCIAL DEL GAS SOBRE EL LÍQUIDO.” X k P