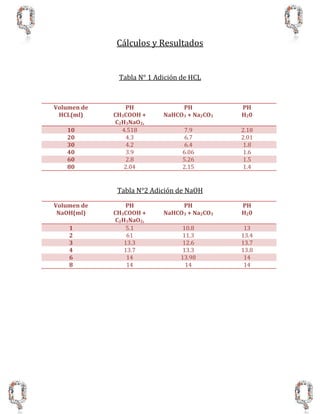
Este documento describe un experimento de laboratorio para determinar el pH de soluciones amortiguadoras ácidas y básicas. Se prepararon dos soluciones amortiguadoras utilizando acetato de sodio y ácido acético, y bicarbonato y carbonato de sodio. Se midió el pH de las soluciones al agregar cantidades crecientes de HCl y NaOH, observando que las soluciones amortiguadoras mantuvieron el pH más estable que el agua pura. El objetivo de determinar la capacidad amortiguadora se logró con éx



![SOLUCIONES BUFFER O AMORTIGUADORAS
Cómo funciona un "Buffer"?.
En lo que podemos denominar "química del acuario" buffer es una o varias sustancias
químicas que afectan la concentración de los iones de hidrógeno (o hidrogeniones) en
el agua. Siendo que pH no significa otra cosa que potencial de hidrogeniones (o peso
de hidrógeno), un "buffer" (o "amortiguador") lo que hace es regular el pH.
Cuando un "buffer" es adicionado al agua, el primer cambio que se produce es que el
pH del agua se vuelve constante.
De esta manera, ácidos o bases (álcalis = bases) adicionales no podrán tener efecto
alguno sobre el agua, ya que esta siempre se estabilizará de inmediato.
¿Qué clase de sustancias químicas son "Buffer"?.
En general, los buffer consisten en sales hidrolíticamente activas que se disuelven en
el agua. Los iones de estas sales se combinan con ácidos y álcalis. Estas sales
hidrolíticamente activas son los productos que resultan de la reacción entre los ácidos
débiles y los álcalis fuertes como el carbonato de calcio (a partir del ácido carbónico e
hidróxido de calcio) o entre ácidos fuertes y álcalis débiles como el cloruro de
amonio [a partir del ácido clorhídrico e hidróxido de amonio]).](https://image.slidesharecdn.com/solucionesamortiguadorasyph-130509194523-phpapp01/85/Soluciones-amortiguadoras-y-ph-4-320.jpg)
![¿Cómo reaccionan estas sales?
Cuando un ácido débil o base débil se combina con su correspondiente sal hidrolítica
en una solución de agua, se forma un sistema amortiguador denominado "buffer".
No siempre un sistema buffer es apropiado para un acuario porque los iones de
algunas sales hidrolíticas pueden dañar a los peces y/o plantas acuáticas.
Por otra parte, cada sistema buffer tiene su propio rango efectivo de pH, algunos de
los cuales no son adecuados para acuarios.
Un sistema buffer natural se forma en la mayoría de los acuarios por la interacción del
dióxido de carbono CO2 producido por el metabolismo normal de los peces, con el
carbonato de calcio (CaCO3) presente en la mayoría de las aguas de acuarios. En estos
casos la primera reacción química que se produce es la de generar un sistema buffer,
tal como vemos seguidamente:
CO2 + H2O 4 H2CO3
_____Dióxido de carbono_________agua ______ Ácido Carbónico_____
H2CO3 → 2H+ + CO3
└Sin disociarse (insoluble) Disociado (soluble) ┘
→ÁCIDO CARBÓNICO→
El ácido carbónico es un ácido débil. Por lo tanto, el balance de la disociación es
desplazado fuertemente en el lado izquierdo de la ecuación; sólo una de algunas
moléculas están disueltas o disociadas.
La reacción entre el ácido carbónico (H2CO3) y el casi insoluble carbonato de calcio
(CaCO3) da lugar a la formación de productos relativamente solubles como el
bicarbonato de calcio [Ca(HCO3)2: H2CO3 + CaCO3→Ca (HCO3) 2→Ca(HCO3)2→Ca++ +
2HCO3-]
Junto a la forma no disociada de ácido carbónico con iones de hidrógeno (H+) los
iones bicarbonato (HCO3-) pueden estar disponibles para evitar cualquier incremento
en los iones de hidrógeno, bloqueando la acidificación.
Esto, desde luego, sucede solamente mientras están libres los iones bicarbonato
disponibles. De otro modo, puede ser logrado a partir del carbonato de calcio
((CaCO3) y bicarbonato de calcio (Ca(HCO)3)2 en el agua.
Este sistema buffer, además, neutraliza los iones hidróxilo (H-) y así puede prevenir la
alcalinización.
Los iones hidróxilo están convertidos por la reacción dentro del agua en iones
bicarbonato y en carbonato de calcio precipitados de esta forma:
Ca (HCO3)2 + OH- →CaCO3 →+ HCO3- +H2O
Este precipitado aparece, además, como consecuencia de que las plantas del acuario](https://image.slidesharecdn.com/solucionesamortiguadorasyph-130509194523-phpapp01/85/Soluciones-amortiguadoras-y-ph-5-320.jpg)