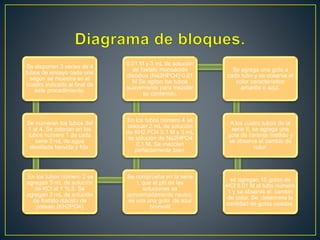
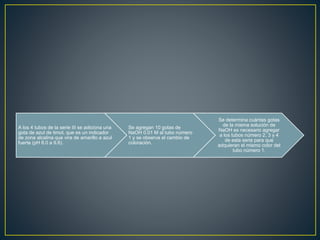
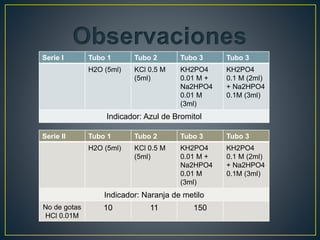
El documento describe un experimento para determinar la capacidad reguladora del pH de soluciones buffer preparadas. Se prepararon tres series de cuatro tubos de ensayo cada una con diferentes soluciones buffer de fosfatos, carbonatos y acetatos y se midió su capacidad para resistir cambios de pH al agregar ácidos o bases. El objetivo era investigar las sustancias necesarias para preparar diferentes tipos de soluciones buffer y su capacidad para amortiguar cambios en el pH.