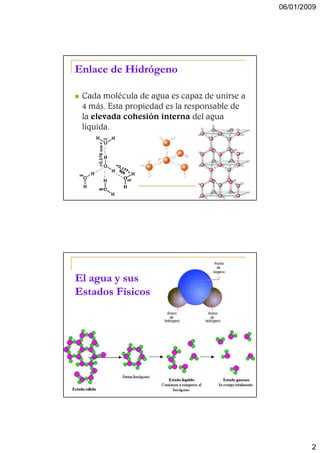
El documento describe las propiedades del agua y su importancia biológica. El agua constituye el 75-80% del volumen celular y un 60% del cuerpo humano. Posee propiedades únicas como su constante dieléctrica elevada, calor específico y de vaporización, y su habilidad para disolver sales e iones. El agua también funciona como medio de reacciones, transporte de moléculas, y amortiguador a través del sistema de bicarbonato.



![06/01/2009
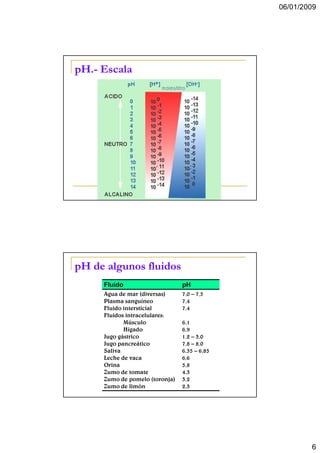
pH
La disolución iónica del agua es un proceso
de equilibrio. Su constante (keq) es:
[H + ] [OH − ]
k eq =
[H 2O ]
La concentración de H2O en agua pura es
elevada (1000/18=55,5M) y la concentración
de iones H+ y OH- es pequeña (1 x 10-7M a
25°C).
pH
La concentración molar del agua no cambia
por su ionización y Keq se expresa:
55,5 Keq = [H+] [OH-]
55,5 Keq se sustituye por Kw (producto iónico
del agua).
Kw (25°C) = 1,0 x 10-14
Base para la escala de pH (concentración de
iones H+)
[H+] = [OH-] = 1,0 x 10-7M
5](https://image.slidesharecdn.com/investigacion3-090712180720-phpapp01/85/bioquimica-del-Agua-5-320.jpg)


![06/01/2009
pH de los amortiguadores
Los buffers contienen en proporciones
análogas, las formas disociada y no disociada
de un ácido débil (A) por ejemplo:
AH A− + H + [ A − ] [H + ]
k=
[ AH ]
Despejando [H+]: [H + ] = k
[ AH ]
[ A− ]
Tomado logaritmos: log [H + ] = log k + log [ AH ]
−
[A ]
pH de los amortiguadores
Utilizando la nomenclatura de pH:
[sal ]
pH = pk + log
[ácido ]
Ejemplo: El ácido acético tiene pK = 4,75. Si
mezclamos un mol de este ácido y dos de
acetato sódico, la proporción sal/ácido será
2:1 y la ecuación dará:
2
pH = 4,75 + log = 4,75 + 0,30 = 5,05
1
9](https://image.slidesharecdn.com/investigacion3-090712180720-phpapp01/85/bioquimica-del-Agua-9-320.jpg)


![06/01/2009
SALES MINERALES
En tres formas:
Precipitadas
Disueltas (iónicas)
Asociadas
Sales Precipitadas
Constituyen estructuras rígidas:
Carbonato de calcio [CaCO3] y fosfato de
calcio [ Ca3(PO4)2 ] en huesos.
Cuarzo [SiO2] en las diatomeas.
Carbonato de calcio [CaCO3] en las
conchas de moluscos.
12](https://image.slidesharecdn.com/investigacion3-090712180720-phpapp01/85/bioquimica-del-Agua-12-320.jpg)
