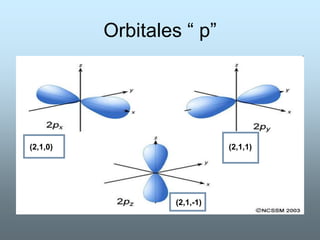
El documento describe la evolución del modelo atómico a lo largo de la historia. Inicialmente, Demócrito propuso que la materia estaba compuesta de átomos indivisibles. Más tarde, científicos como Dalton, Thomson y Rutherford realizaron experimentos que llevaron al descubrimiento del electrón y al modelo de átomo con núcleo y electrones orbitando. Finalmente, Bohr, Heisenberg y Schrödinger desarrollaron el modelo cuántico actual del átomo mediante la mecánica cuántica y los números cu