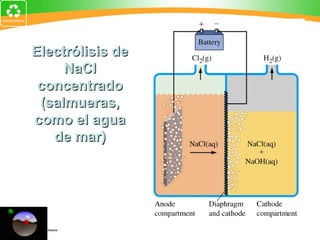
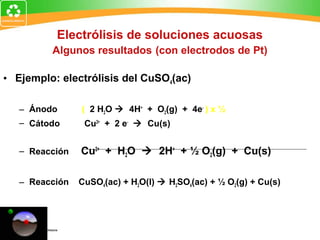
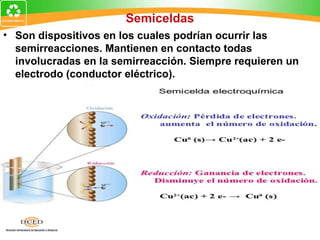
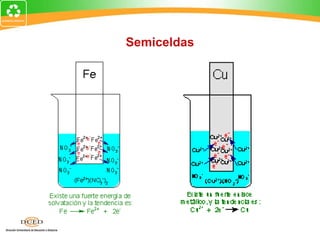
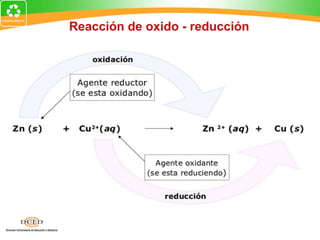
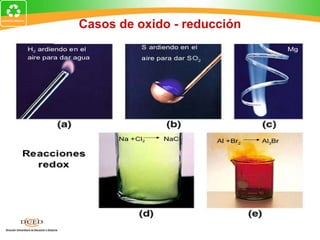
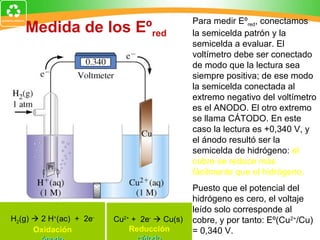
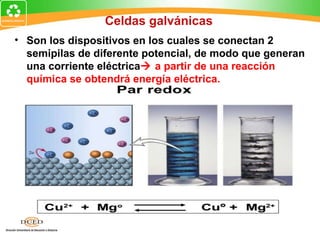
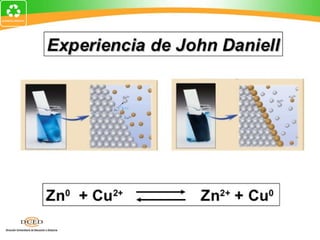
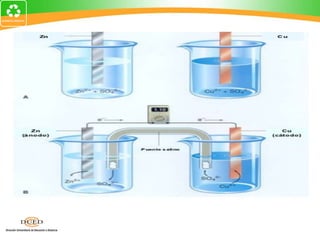
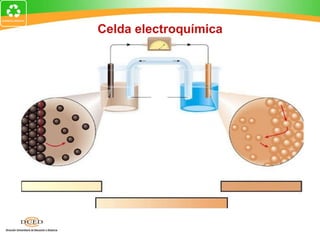
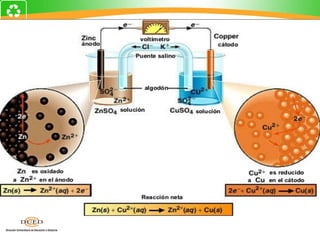
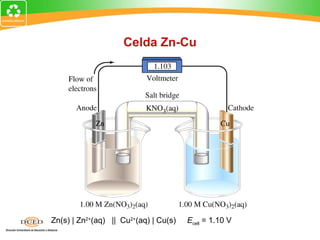
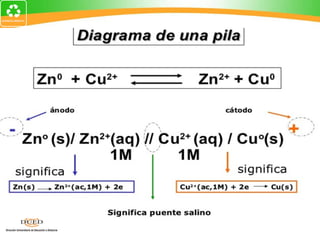
Este documento resume conceptos clave de electroquímica como semiceldas, potenciales estándar de reducción, celdas galvánicas, celdas electrolíticas y algunos ejemplos. Explica cómo medir potenciales de reducción usando la semicelda patrón de hidrógeno. Describe celdas como Zn-Cu y cómo calcular su fuerza electromotriz. También cubre procesos como electrólisis de NaCl fundido y soluciones acuosas.



















![Electrólisis
de NaCl
fundido
En este caso las reacciones son:
Cátodo (reducción): [Na+
+ e-
Na(l)]x2
Ánodo (oxidación): 2 Cl-
Cl2(g) + 2e-
Reacción global: 2Na+
+ 2 Cl-
2 Na(l) + Cl2(g)
NaCl(l)](https://image.slidesharecdn.com/semana6electroquimica-130422193244-phpapp02/85/Semana-6-electroquimica-33-320.jpg)
![Electrólisis de NaCl fundido
En este caso los potenciales serían:
Cátodo (reducción): [Na+
+ e-
Na(l)]x2 Eº =
-2.71 V
Ánodo (oxidación): 2 Cl-
Cl2(g) + 2e-
Eº = -1.36 V
Reacción global: 2Na+
+ 2 Cl-
2 Na(l) + Cl2(g) Eº = -4.07 V
Es decir la fuente de corriente continua debe tener al
menos un potencial de 4.07 V, para que la reacción
ocurra !](https://image.slidesharecdn.com/semana6electroquimica-130422193244-phpapp02/85/Semana-6-electroquimica-34-320.jpg)