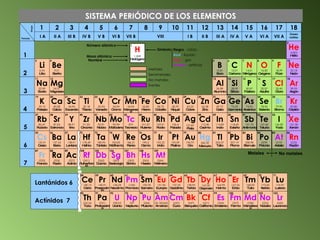
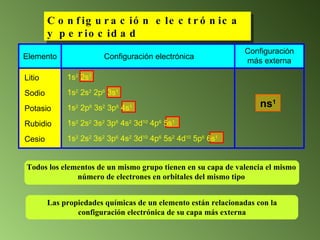
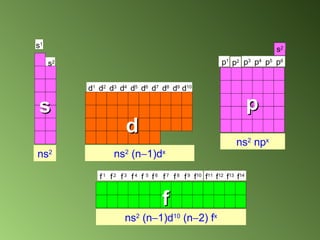
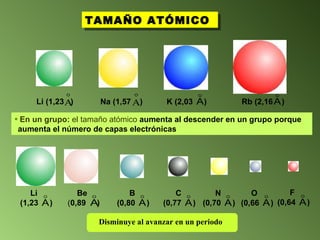
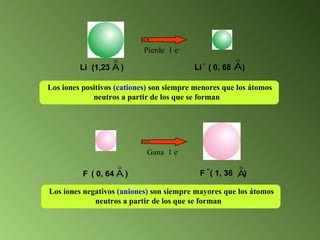
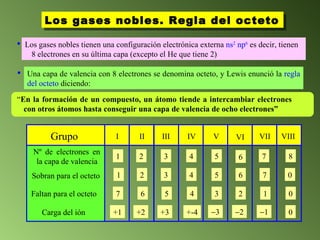
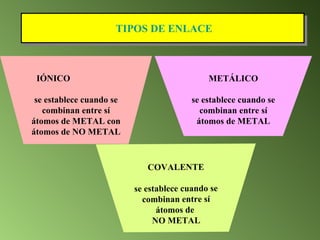
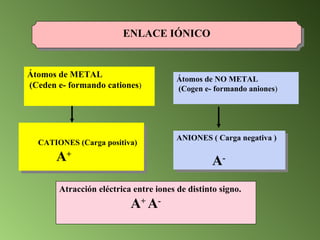
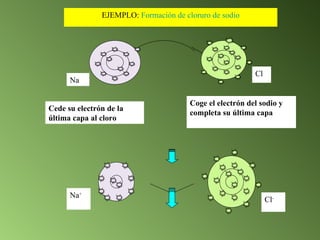
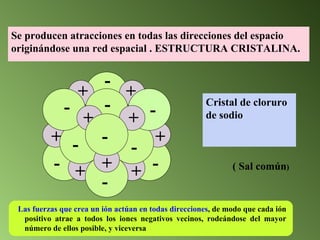
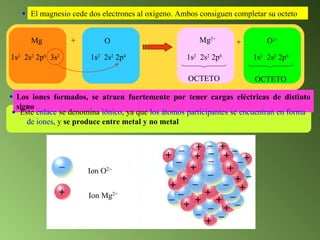
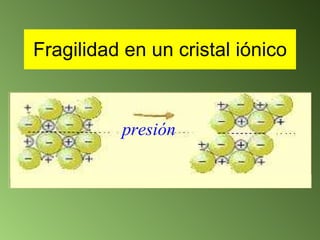
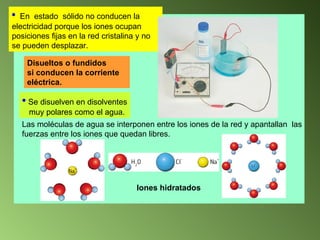
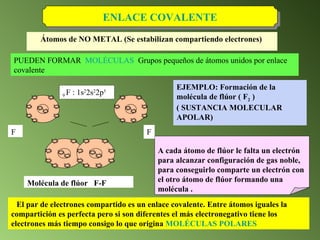
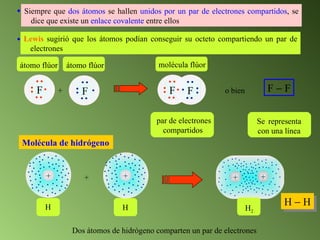
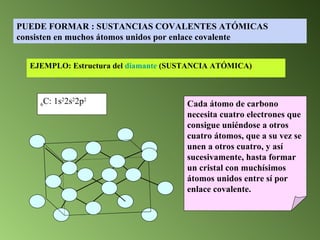
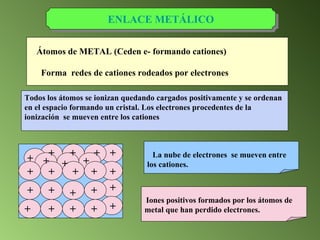
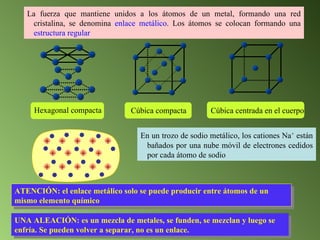
Este documento describe el sistema periódico de los elementos. Explica que los elementos están organizados por número atómico creciente y que los elementos de un mismo grupo tienen propiedades químicas similares. También describe cómo varían el tamaño atómico, el potencial de ionización y la electronegatividad de los elementos a través del sistema periódico.