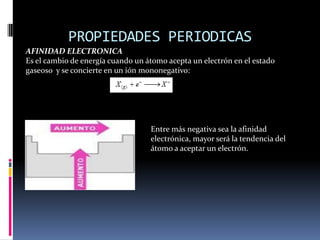
Este documento resume las propiedades periódicas de los elementos químicos según la tabla periódica propuesta por Mendeleev en 1869. Explica que las propiedades como el potencial de ionización, afinidad electrónica, electronegatividad, radio atómico y volumen atómico varían de forma periódica y regular a medida que los elementos se ordenan en la tabla. Luego define y describe cada una de estas propiedades periódicas.