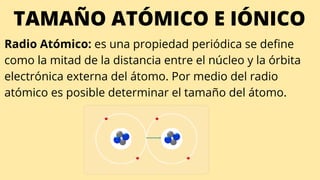
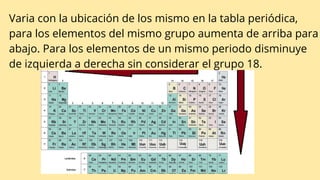
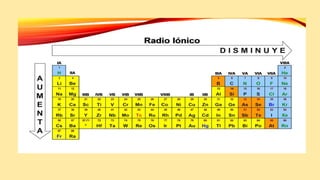
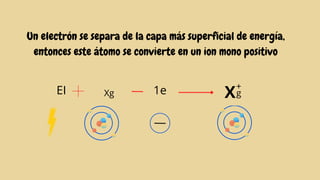
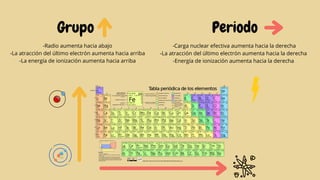
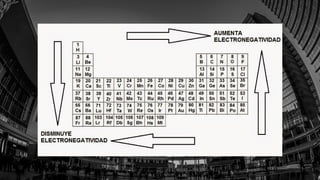
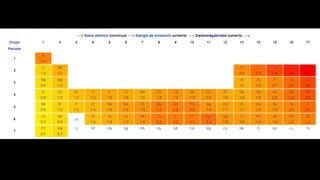
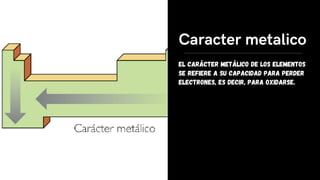
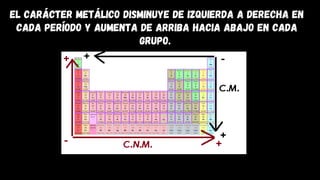
Este documento describe varias propiedades periódicas importantes como el radio atómico, energía de ionización, electronegatividad y carácter metálico. Explica cómo estas propiedades varían sistemáticamente a través de la tabla periódica, ya sea aumentando o disminuyendo al moverse de izquierda a derecha o de arriba hacia abajo. También proporciona ejemplos para ilustrar cómo estas propiedades afectan el tamaño de los átomos e iones.











![Amigos de la Química. (10 de septiembre de 2017) QUÍMICA. Energía
de ionización [Archivo de Video] YouTube.
https://www.youtube.com/watch?v=F1u-
_vnGo8o&ab_channel=AmigosdelaQu%C3%ADmica
Ortega.G (2014) propoedades peródicas -obtenido de
https://www.abc.com.py/edicion-
impresa/suplementos/escolar/propiedades-periodicas-de-los-
elementos-1227981.html](https://image.slidesharecdn.com/electronegatividad-230207025423-66d232e5/85/Electronegatividad-pdf-22-320.jpg)