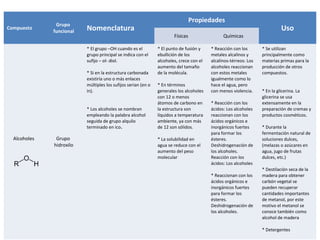
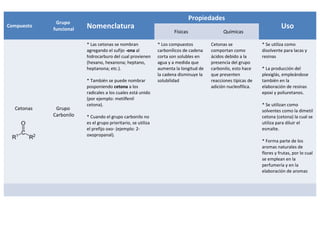
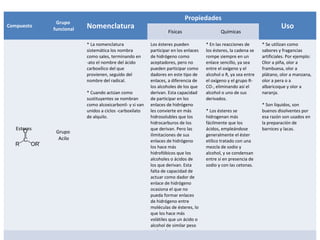
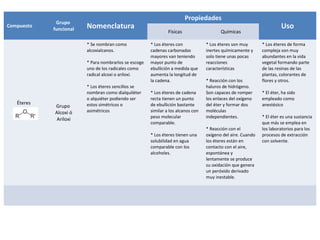
Este documento describe las propiedades físicas, químicas, nomenclatura y usos de varios grupos funcionales orgánicos, incluidos alcoholes, cetonas, ésteres, éteres, aminas, ácidos carboxílicos y halogenuros de alquilo. Resume sus características clave y cómo se usan en aplicaciones industriales y de la vida diaria.