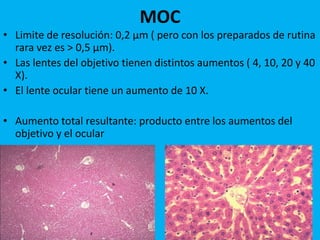
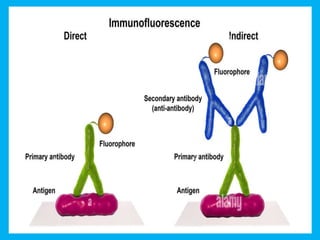
Este documento describe las técnicas histológicas utilizadas para preparar muestras de tejido para su observación bajo el microscopio óptico y electrónico. Explica los pasos de fijación, inclusión, corte, tinción e identificación de estructuras celulares y tisulares. También describe los principales tipos de microscopía como la óptica, fluorescencia, contraste de fases y electrónica, así como las técnicas especiales de tinción e inmunohistoquímica.