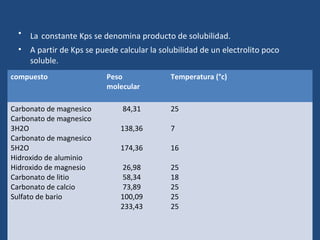
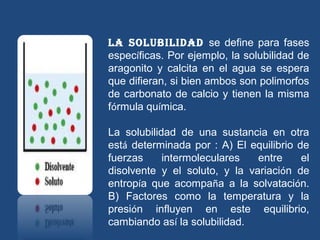
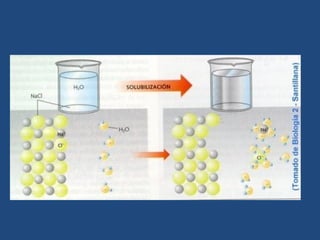
La solubilidad depende de varios factores como las propiedades del soluto y el solvente, la temperatura, el pH y la presencia de otras sustancias. Las soluciones ideales siguen la ley de Raoult, mientras que la solubilidad real puede verse afectada por las interacciones entre las moléculas del soluto y el solvente.

























![Para ácidos débiles
PH-pKa = log [A-] / [AH]
Para bases débiles
PH-pKa = log [BOH] / [B+]
Para los solutos anfóteros, el punto
isoeléctrico es aquel pH en que se produce la
mínima solubilidad.
El pH de óptima solubilidad no siempre
coincide con el pH de máxima estabilidad.](https://image.slidesharecdn.com/tec3listoparaprimerparcil-130407102350-phpapp02/85/Tec-3-listo-para-primer-parcil-28-320.jpg)









































![Estimación de la solubilidad en
mesclas disolventes.
• El método de Hildebrand ampliado fue
propuesto por Martin y cols. Para calcular la
solubilidad de principios activos semi polares en
mesclas disolventes polares .
• El método consiste en relacionar
[1n (X½/X2)]/A=C0+w c,8n
Simplificado a
1n X2 =C0+w c,8n](https://image.slidesharecdn.com/tec3listoparaprimerparcil-130407102350-phpapp02/85/Tec-3-listo-para-primer-parcil-78-320.jpg)
![Estimación dela solubilidad de
electrolitos débiles.
• Muchos principios activos son electrolitos
débiles y se ionizan parcialmente en
disolución.
• La solubilidad total (SH) del principio activo es
igual a la suma de la solubilidad que
corresponde a las especies no ionizadas (So)
que a su vez depende del pH del medio. Para
un acido.
S=So + [A-]](https://image.slidesharecdn.com/tec3listoparaprimerparcil-130407102350-phpapp02/85/Tec-3-listo-para-primer-parcil-79-320.jpg)