Enzimas: definición, tipos, factores que afectan su actividad y aplicaciones clínicas
- 1. PALABRA GRIEGA ; ZYME “ EN FERMENTO”
- 2. Objetivos • Definir que es una enzima y cómo éstas actúan en reacciones dentro de la célula. • Identificar diferentes factores que pueden afectar la actividad enzimática. • Diferenciar entre inhibición competitiva y no- competitiva..
- 3. “Las enzimas son proteínas que aceleran reacciones químicas en los seres vivos , actuando como biocatalizadores ”. Que son las enzimas?
- 4. ENZIMAS son BIOCATALIZADORES ORGÁNICOS Aceleradores de reacciones químicas (en este caso, bioquímicas) De naturaleza proteica. GLOBULARES apoenzima Grupo prostético
- 5. Un catalizador es una sustancia que acelera una reacción química, sin formar parte de los productos finales ni desgaste en el proceso, hasta hacerla instantánea o casi instantánea. Un catalizador acelera la reacción al disminuir la energía de activación. Que es un catalizador?
- 6. MECANISMO DE ACCIÓN La presencia de los enzimas disminuyen la energía de activación aumentando así su velocidad.
- 7. En una reacción catalizada por un enzima: 1.La sustancia sobre la que actúa el enzima se llama sustrato 2. El sustrato se une a una región concreta del enzima, llamada centro activo 3. Se forman los productos y el enzima ya puede comenzar un nuevo ciclo de reacción Etapas de la reacción enzimática E E E E
- 10. Una enzima puede unir dos sustratos en su sitio activo
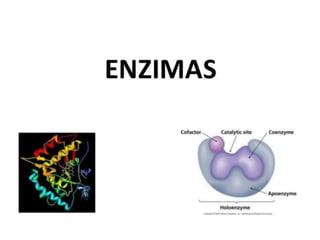
- 11. Algunas enzimas actúan con la ayuda de estructuras no proteícas. Cofactor. Cuando se trata de iones o moléculas inorgánicas. Coenzima. Cuando es una molécula orgánica. Se puede señalar, que muchas vitaminas funcionan como coenzimas. Continuación...
- 13. Coenzimas • Las coenzimas son pequeñas moléculas orgánicas, que se unen a la enzima. • Las coenzimas colaboran en la reacción enzimática recibiendo transitoriamente algún grupo químico: H+ , OH, CH3 . • La enzima sin la coenzima recibe el nombre de APOENZIMA
- 14. El NAD es una coenzima aceptora o donadora de H Sustrato oxidado Mecanismo de acción de la coenzima
- 15. Mecanismo de acción de la coenzima 1.- la coenzima se une a una enzima 2.- la coenzima capta su sustrato específico 3.-la enzima ataca al sustrato, arrancádole algunos átomos. 4.-la enzima cede a la coenzima dichos átomos provenientes del sustrato. 5.-la coenzima acepta dichos átomos y se desprende de la enzima 6.- la coenzima no es la aceptor final de dichos átomos, sino que debe liberarlos tarde o temprano 7.- la coenzima transporta dichos átomos y acaba cediéndolos, recuperando así su capacidad para aceptar nuevos átomos
- 16. Coenzimas importantes 1.FAD (flavín-adenín dinucleótido): transferencia de electrones y protones. 2. FMN (Flavín mononucleótido): transferencia de electrones y protones. 3. NAD+(nicotín-adenín dinucleótido): transferencia de electrones y protones. 4. NADP+ (nicotín-adenín dinucleótido fosfato): transferencia de electrones y protones. 5. Coenzima A: transferencia de grupos acetilo (por ejemplo, en la descarboxilación del ácido pirúvico).
- 17. Algunas enzimas requieren metales (cofactores) para mejorar su actividad
- 18. Las células producen enzimas? • La enzimas son producidas en las células. • puede encontrarse libres en citoplasma celular, incluidas en organelas celulares o integradas en estructuras de membranas. • Las enzimas pueden actuar dentro de la célula , fuera de ésta.
- 19. Características estructurales de las enzimas La estructura de una enzima es similar a la de una proteína y se describe en cuatro niveles diferentes: estructura primaria, secundaria, terciaria y cuaternaria
- 20. Propiedades de las enzimas • se desnaturalizan al ser sometidas a cambios de pH, a variaciones de temperatura y a elevadas concentraciones salinas . • Las enzimas actúan en pequeña cantidad y se recuperan indefinidamente. • Los enzimas son específicas: cada enzima cataliza un solo tipo de reacción, y casi siempre actúa sobre un único sustrato o sobre un grupo muy reducido de ellos.
- 21. La alta especificidad se debe a que su estructura terciaria le permite formar cavidades llamadas sitios activos, lugar donde se ubica el sustrato durante el proceso de catálisis.
- 22. FACTORES QUE MODIFICAN LA ACTIVIDAD ENZIMATICA 1.-Cambios en el pH 2.- Cambios en la temperatura 3.- Concentración del sustrato
- 23. pH • Cada enzima tiene un pH óptimo en el cual la actividad enzimática es máxima. Ligeros cambios del pH pueden provocar la desnaturalización de la proteína.
- 24. Temperatura • Cada enzima tiene una temperatura óptima en la cual su actividad es máxima • Los aumentos de temperatura por lo general aceleran las reacciones químicas., solo que al ser proteínas a partir de cierta temperatura se empiezan a desnaturalizar
- 25. Nomenclatura de las enzimas • se las denomina según el sustrato sobre el cual actúan agregando el sufijo "asa“, ej lipasa, amilasa , lactasa, sacarasa, etc. • Se presentan ciertas excepciones como es el caso de algunas enzimas que no terminan en asa, como son la pepsina, quimosina, tripsina.
- 26. ISOZIMAS • Las isoenzimas o isozimas son enzimas que difieren en la secuencia de aminoácidos (molecularmente son diferentes), pero que catalizan la misma reacción química. • Ej. Amilasa salival • Amilasa pancreática
- 27. Zimógenos • Llamadas también proenzimas. • Son precursores de enzimas que se convierten en enzimas activas por un proceso de hidrólisis. • Algunas enzimas digestivas son zimógenos secretados por las glándulas, que se activan al llegar a la luz del tracto gastrointestinal.
- 28. Enzimas anormales por alteración genética • Toda alteración de la secuencia de aminoácidos en su estructura puede alterar seriamente la actividad de dicha enzima incapaces de responder a las demandas fisiológicas. • A consecuencia se producen los errores congénitos del metabolismo.
- 29. • Estas fallas ocasionan bloqueos en la vía metabólica de la cual forma parte la enzimas, produciendo trastornos muy serios incluso a veces incompatibles con el desarrollo de la vida.
- 31. CLASIFICACIÓN DE LOS ENZIMAS En función de su acción catalítica específica, dintiguimos 6 grandes grupos : 1: OXIDORREDUCTASAS 2: TRANSFERASAS 3: HIDROLASAS 4: LIASAS 5: ISOMERASAS 6: LIGASAS
- 32. OXIDOREDUCTASAS Catalizan reacciones de oxidorreducción, es decir, transferencia de hidrógeno (H) o electrones (e-) de un sustrato a otro, según la reacción general: AH2 + B A + BH2 Ejemplos son la succinato deshidrogenasa o la citocromo c oxidasa.
- 33. TRANSFERASAS Catalizan la transferencia de un grupo químico (distinto del hidrógeno) de un sustrato a otro, según la reacción: A-B + C A + C-B Un ejemplo es la glucoquinasa, que cataliza la reacción siguiente: glucosa + ATP ADP + glucosa-6- fosfato
- 34. HIDROLASAS Catalizan las reacciones de hidrólisis (ruptura de moléculas en presencia de agua): lactosa + agua glucosa + galactosa
- 35. LIASAS Catalizan reacciones de ruptura de sustratos en ausencia de agua: A- B A + B Un ejemplo es la acetacetato descarboxilasa, que cataliza la reacción: ácido acetacético CO2 + acetona
- 36. ISOMERASAS Catalizan la interconversión de isómeros: A B Un ejemplo, la fosfotriosa isomerasa que cataliza las reacción representada: gliceraldehído-3-fosfato dihidroxiacetona- fosfato
- 37. LIGASAS Catalizan la unión de dos sustratos con hidrólisis simultánea de un nucleótido trifosfato (ATP, GTP, etc.): A + B + XTP A-B + XDP + Pi Un ejemplo es la piruvato carboxilasa
- 38. INHIBIDORES ENZIMÁTICOS • son agentes químicos que inhiben la acción catalítica de enzimas • La inhibición puede ser de dos clases: Reversible irreversible
- 39. Inihibidores reversibles • Se unen a la enzima por el mismo tipo de interacciones que se producen entre las enzimas y los sustratos. • Hay INHIBIDORES COMPETITIVOS Y NO COMPETITIVOS.
- 40. Inhibidores competitivos Compiten con el sustrato por ocupar el sitio activo de la enzima. Tiene una estructura similar a la del sustrato por lo que tiene posibilidad de formar el complejo ES. Pero este complejo no da productos y disminuye el número de moléculas de Enzima libre para interaccionar con el Sustrato.
- 41. • Sulfas (inhibe pasos metabólicos en bacterias) y fluoruracilo tratamiento de cáncer, actúan así.
- 42. inhibidores no competitivos • La unión se hace en un sitio distinto al sitio activo y por eso puede formarse el complejo EIS que no da producto.
- 43. La presencia del inhibidor actúa como si disminuyese la concentración de la Enzima presente y por eso nunca se llega a la velocidad máxima por más que se aumente la concentración de sustrato.
- 45. Inhibidores irreversibles • Toda sustancia que produzca un cambio permanente en la molécula de la enzima, que resulte en un deterioro definitivo de su capacidad catalítica. • Venenos organofosforados (insecticidas) bloquen a la enzima aceticolinesterasa. • Cianuro(al unirse al Fe de los citopcromos, catalasa y peroxidasas bloquean su actividad)
- 46. Enzimas del plasma sanguíneo Determinación de enzimas en el laboratorio • enzimas no específicas: Enz. De secreción o extracelulares Enzimas intracelulares • Enzimas específicas: Trombina Plasmina lipoproteinlipasa
- 47. Enzimas de importancia clínica Transaminasas. • Enzimas sintetizadas en el tejido hepático, cardiaco y del músculo estriado. • Son 2 la GOT y GPT, su medición laboratorial ayudan en el diagnóstico de enfermedades hepatocelulares y por tanto son indicadores para evaluar la función hepática.
- 48. • En caso de daño severo en el hígado, como en la hepatitis viral aguda, la ALT y la AST pueden estar elevadas en plasma sanguíneo desde niveles en las centenas (100-300 U/L). altas hasta más de 1,000 U/L.
- 49. fosfatasa alcalina y la GGT son enzimas que se incrementan en una gran cantidad de trastornos que afectan el drenaje de la bilis, como cuando existe un tumor o por cálculos que bloquean el conducto normal de la bilis, o una enfermedad hepática que ocasiona un bloqueo del flujo de la bilis en los conductos intrahepáticos.
- 50. • La fosfatasa alcalina puede hallarse también en otros órganos, como hueso, placenta e intestino. Por esta razón, la medición de la enzima GGT se utiliza como una prueba suplementaria para asegurarse de que el incremento en la fosfatasa alcalina verdaderamente proviene del sistema biliar o del hígado. En contraste con la fosfatasa alcalina, la GGT no aparece incrementada en la enfermedad de hueso, placenta o intestino.
- 51. Valores de referencia • GOT hasta 40 UI/L • GPT hasta 38 UI/L • FA en adultos hasta 240 UI/L • FA en niños hasta 400 UI/L • Alfaglutamiltransferasa ( GGT) hasta 0-40 U/L
- 52. Amilasa pancreática 60 – 150 U/L • Enzima que hidroliza el almidón , es secretada por el páncreas, su elevación en sangre indica pancreatitis, perforación del páncreas, embarazo ectópico o un abdomen agudo.
- 53. Fosfatasa ácida: • Sintetizada en hígado • Se encuentra en eritrocitos, próstata, hígado, páncreas. • Se eleva en procesos malignos : cáncer de próstata, vejiga.
- 54. • Deshidrogenasa láctica 45 a 235UI/L • Creatinkinasa 25-195 UI/L • CK –MB 0 -25U/L son dos enzimas que permiten una valoración clínica del infarto del miocardio.
- 55. Enzimas digestivas • Las enzimas digestivas son enzimas que rompen los polímeros presentes en los alimentos en moléculas más pequeñas que puedan ser absorbidas con facilidad.
- 56. Secreciones del tubo digestivo las glándulas anejas Bilis Existen enzimas digestivas en la saliva, en el jugo gástrico, en el jugo pancreático y en las secreciones intestinales
- 57. • Amilasas: Las denominadas amilasas son aquellas enzimas con función de romper los enlaces glucosídicos entre monosacáridos dejándolos de forma individual para ser asimilados. Hay tres tipos de amilasas dependiendo de su lugar de origen, estas son la amilasa salival o ptialina, amilasa pancreática y amilasa intestinal (del duodeno).
- 58. Lipasas Las lipasas son enzimas específicas originadas en el páncreas que poseen la función de disociar los enlaces covalentes entre lípidos complejos llevándolos al estado de gliceroles y ácidos grasos asimilables por el organismo.
- 59. Colesterolsas: Cataliza la hidrólisis de ésteres de colesterol con ácidos grasos. Fosfolipasa: Cataliza hidrólisis del enlace éster que une el ácido graso al hidroxilo del glicerol formándose ácidos grasos y lisofosfolípido
- 60. Peptidasas o proteasas: Este grupo enzimático, que se origina en el estómago o en el páncreas, posee la capacidad de actuar sobre los enlaces peptídicos de las macromoléculas proteicas reduciéndolas a monómeros orgánicos denominados aminoácidos.
- 61. Pepsina: • Principal enzima del jugo gástrico • Hidroliza parcialmente las proteínas • Secretada como zimógeno pepsinógeno • Actúa en PH ácido • Activada por la acción de HCL • Es endopeptidasa.
- 62. Tripsina: Enzima del jugo pancreático Secretada en el páncreas como zimógeno tripsinógeno. Se activa por la acción de la enteroquinasa Actúa en Ph alcalino Hidroliza péptidos Es endopeptidasa
- 63. Quimotripsina: Enzima del jugo pancreático Secretada por el páncreas como zimógeno quimotripsinógeno Se activa por la acción de la tripsina. Actua en Ph alcalina Hidroliza uniones peptídicas Es endopeptidasa
- 64. Carboxipeptidasas: Secretada por el páncreas como zimógeno pro-carboxipeptidasa. Activada por la tripsina Actúa en PH alcalino Hidroliza uniones peptídicas adyacentes al grupo carboxilico terminal.
- 65. Elastasa: Secretada por el páncreas como zimógeno proelastasa. Es activada por la tripsina Hidroliza uniones peptídicas en la elastina Ribonucleasa y deoxirribonucleasa: Actúan hidrolizando uniones de nucleótidos Actúan en Ph alcalino