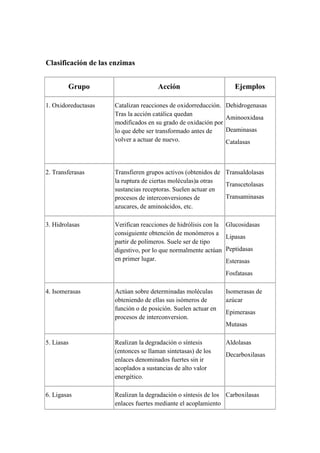
Las enzimas son proteínas que catalizan reacciones químicas en las células, acelerándolas hasta millones de veces sin ser consumidas. Casi todos los procesos celulares requieren enzimas. Las enzimas se clasifican por la reacción que catalizan, como oxidorreductasas, transferasas e hidrolasas.