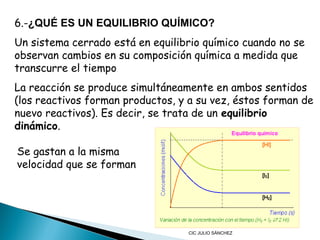
Este documento trata sobre la cinética y el equilibrio químico. Explica conceptos como la velocidad de reacción, la ecuación de velocidad, los factores que afectan la velocidad como la concentración, temperatura y catalizadores. También define el equilibrio químico y la constante de equilibrio Kc.

![1.-VELOCIDAD DE REACCIÓN
Cuando se produce una reacción química, las
concentraciones de cada uno de los reactivos y productos
va variando con el tiempo, hasta que se produce el
equilibrio químico, en el cual las concentraciones de todas
las sustancias permanecen constantes.
La velocidad de una reacción es la
derivada de la concentración de un
reactivo o producto con respecto
al tiempo tomada siempre como
valor positivo.
[HI]
t (s)
Es decir, es el cociente de la variación de la concentración
de algún reactivo o producto por unidad de tiempo cuando
los intervalos de tiempo tienden a 0. la unidad de la velocidad
de reacción serán: mol. LΔ[Sustancia] d[Sustancia]
v = lim
=
1 -1
·s
∆t →0
Δt
dt
CIC JULIO SÁNCHEZ](https://image.slidesharecdn.com/tema6-140126110617-phpapp02/85/Tema-6-2-320.jpg)
![En la reacción estándar: a A +b B⇄ c C +d D:
d [ A]
d [B ]
d [C ]
d [D ]
v =−
=−
=
=
a × dt
b × dt c × dt d × dt
Como la velocidad es positiva según transcurre la reacción
hacia la derecha, es decir según va desapareciendo los
reactivos, es necesario poner un signo “–” delante de las
concentraciones de éstos.
Ej: Expresar la velocidad de la siguiente reacción química en
función de la concentración de cada una de las especies
implicadas en la reacción: 4 NH3 (g) + 3 O2 (g) ⇄ 2 N2 (g) + 6
H2O (g)
d [NH3 ]
d [O2 ] d [N2 ] d [H2O ]
v=−
=−
=
=
4 × dt
3 × dt 2 × dt
6 × dt
CIC JULIO SÁNCHEZ](https://image.slidesharecdn.com/tema6-140126110617-phpapp02/85/Tema-6-3-320.jpg)
![2.-ECUACIÓN DE VELOCIDAD
En general, la velocidad depende de las concentraciones de
los reactivos siguiendo una expresión similar a la siguiente
para la reacción estándar: a A + b B c C + d D
v = × A]n ×B ]m
k
[
[
Es importante señalar que “m” y “n” no tienen porqué
coincidir con los coeficientes estequiométricos “a” y “b”,
sino que se determinan experimentalmente.
A la constante “k” se le denomina constante de velocidad
(No confundir con Kc o Kp)
Ejemplos:
Las reacciones: a) H2 (g) + I2 (g) 2 HI (g) y b) H2 (g) + Br2
(g)2 HBr (g)
tienen ecuaciones de velocidad diferentes: a) v = k [H2] [I2]
b) v = k [H2] [Br2]1/2
CIC JULIO SÁNCHEZ](https://image.slidesharecdn.com/tema6-140126110617-phpapp02/85/Tema-6-4-320.jpg)
![En la expresión: v = k [A]nx[B]m se denomina orden de
reacción al valor suma de los exponentes “n + m”.
Se llama orden de reacción parcial a cada uno de los
exponentes. Es decir, la reacción anterior es de orden “ n” con
respecto a A y de orden “m” con respecto a B.
H2 (g) + I2 (g) 2 HI (g)
v = k [H2] [I2]
Reacción de segundo orden (1 + 1)De primer orden respecto al
H2 y de primer orden respecto al I2.
k es
una constante, llamada constante de velocidad, característica
de cada reacción química. Su valor:
Depende de la temperatura.
Es independiente de las concentraciones de los productos de la
reacción.
Sus unidades dependen de la ecuación de velocidad, es decir,
dependen de la reacción química y son tales que hacen
coherente las unidades de la ecuación de velocidad. Su valor
CIC JULIO SÁNCHEZ
también se suele determinar experimentalmente](https://image.slidesharecdn.com/tema6-140126110617-phpapp02/85/Tema-6-5-320.jpg)
![2.1Determinación de la ecuación de velocidad
Consiste en medir la velocidad inicial manteniendo las
concentraciones de todos los reactivos constantes excepto
la de uno y ver cómo afecta la variación de éste al valor de la
velocidad.
Si por ejemplo, al doblar la concentración de un reactivo la
velocidad se multiplica por cuatro, podemos deducir que el
orden parcial respecto a ese reactivo es “2”.
Ejemplo:
Determinar el orden de reacción: CH3Cl(g) + H2O(g) CH3-OH(g) + HCl(g)
usando los datos de la tabla.
Experiencia
[CH3-Cl] (mol/l)
[H2O] (mol/l)
v (mol·l–1·s–1)
1
0,25
0,25
2,83
2
0,50
0,25
5,67
3
0,25
0,5
11,35
CIC JULIO SÁNCHEZ](https://image.slidesharecdn.com/tema6-140126110617-phpapp02/85/Tema-6-6-320.jpg)



![4.- MECANISMOS DE REACCIÓN. MOLECULARIDAD
La reacción: H2 (g) + I2 (g) 2 HI (g), cuya ecuación de
velocidad tiene la forma: v = k [H2] [I2], es una reacción
elemental (que sucede en una sola etapa) y para que suceda
es necesario el choque de dos moléculas (una de H2 y otra de
I2). Se dice que es una reacción “bimolecular”.
Se llama molecularidad al número de moléculas de reactivos
que colisionan simultáneamente para formar el complejo
activado en una reacción elemental. Se trata de un número
entero y positivo. Así hablamos de reacciones unimoleculares,
bimoleculares, trimoleculares, etc… Generalmente, en
reacciones elementales, coincide con el orden de reacción.
Sin embargo, existen casos en los que no coinciden, como las
reacciones de hidrólisis en los que interviene una molécula de
agua ya que al ser [H2O] prácticamente constante la
velocidad es independiente de ésta.
CIC JULIO SÁNCHEZ](https://image.slidesharecdn.com/tema6-140126110617-phpapp02/85/Tema-6-10-320.jpg)
![Es raro que una reacción intervengan más de tres moléculas,
pues es muy poco probable que chocan entre sí
simultáneamente con la energía y orientación adecuadas.
Por dicha razón, la mayoría de las reacciones suceden en
etapas. El conjunto de estas etapas se conoce como
“mecanismo de la reacción”. Las sustancias que van
apareciendo y que no son los productos finales se conocen
como “intermedios de reacción”.
La velocidad de la reacción dependerá de las sustancias que
reaccionen en la etapa más lenta.
Ejemplo de mecanismo de reacción :
La reacción siguiente: NO2 (g) + CO (g) NO (g) + CO2 (g) sucede en dos
etapas:
1ª etapa (lenta): 2 NO2 NO + NO3
2ª etapa (rápida): NO3 + CO NO2 + CO2
La reacción global es la suma de las dos. NO3 es un “intermedio de
reacción”. Como en la etapa lenta intervienen dos moléculas de NO2,
v = k [NO2]2
CIC JULIO SÁNCHEZ](https://image.slidesharecdn.com/tema6-140126110617-phpapp02/85/Tema-6-11-320.jpg)








![Equilibrio:
Cl 2 (g)
Moles inic.:
0
Moleseq(mol/l)
conc. equil.
x
PCl 5 (g) ↔
PCl 3 (g) +
3/208,2
0
0,0144 − x
x
x
0,0144 – x
x
0,25
0,25
0,25
x
x
g
[PCl 3 ] × [Cl 2 ] 0,25 0,25
KC =
=
= 0,48 ⇒ x = 0,0130
0,0144 − x
[PCl 5 ]
0,25
Moles equil.
CIC
0,0014 JULIO SÁNCHEZ
0,013
0,013](https://image.slidesharecdn.com/tema6-140126110617-phpapp02/85/Tema-6-21-320.jpg)



![9-GRADO DE DISOCIACIÓN (a).
Se utiliza en aquellas reacciones en las que existe un único
reactivo que se disocia en dos o más moléculas más
pequeñas.
Es la fracción de un mol que se disocia (tanto por 1). En
consecuencia, el % de sustancia disociada es igual a 100· α
Sea una reacción A ⇄ B + C.
Si llamamos “c” = [A]inicial y suponemos que en principio
sólo existe sustancia “A”, tendremos que:
Equilibrio: A ⇄ B + C
Conc. Inic. (mol/l): c 0 0
conc. eq(mol/l) c(1– a) c a c · a
En el caso de que la sustancia esté poco disociada (KC muy
pequeña): a << 1 y KC = c α 2, con lo que se tiene α de
manera inmediata.
CIC JULIO SÁNCHEZ](https://image.slidesharecdn.com/tema6-140126110617-phpapp02/85/Tema-6-25-320.jpg)

![En caso de duda, puedes despreciar, y si ves que α <
0,02, puedes dejar el resultado, mientras que si α > 0,02
conviene que no desprecies y resuelvas la ecuación de
segundo grado .
10.-COCIENTE DE REACCIÓN (Q)
En una reacción cualquiera: a A + b B ⇄c C + d D se llama
cociente de reacción a:
[C ]c × D ]d
[
Q =
[ A]a × B]b
[
Tiene la misma fórmula que la KC pero a diferencia de
ésta, las concentraciones no tienen porqué ser las del
equilibrio.
Si Q = Kc entonces el sistema está en equilibrio.
CIC JULIO SÁNCHEZ](https://image.slidesharecdn.com/tema6-140126110617-phpapp02/85/Tema-6-27-320.jpg)






![13-.EQUILIBRIOS HETEROGÉNEOS.
Se habla de reacción homogénea cuando tanto reactivos
como productos se encuentran en el mismo estado físico.
En cambio, si entre las sustancias que intervienen en la
reacción se distinguen varias fases o estados físicos,
hablaremos de reacciones heterogéneas.
Por ejemplo, la reacción: CaCO3(s) CaO(s) + CO2(g) se
trata de un equilibrio heterogéneo.
Aplicando la ley de acción de masas se cumplirá que:
[CaO ] × [CO2 ]
= K (constante)
[CaCO3 ]
Sin embargo, las concentraciones (n/V) de ambas
sustancias sólidas (CaCO3 y CaO) son constantes, al igual
que las densidades de sustancias puras (m/V) son también
constantes.
:
CIC JULIO SÁNCHEZ](https://image.slidesharecdn.com/tema6-140126110617-phpapp02/85/Tema-6-34-320.jpg)
![Por ello, agrupando las constantes en una sola a la que
llamaremos KC se tiene:
K × [CaCO3 ]
KC =
= [CO2 ] ⇒ KC = [CO2 ]
[CaO]
13.1 EQUILIBRIOS DE SOLUBILIDAD
Cuando tratamos de disolver una sustancia sólida
(por ejemplo, una sal) en un disolvente, las partículas del
sólido pasan al líquido, y la cantidad de sólido disminuye.
Puede llegar un momento en que la disolución quede
saturada por el sólido estableciéndose un equilibrio entre
la disolución saturada y el propio sólido.
El equilibrio de solubilidad se establece entre una sustancia
sólida y esa sustancia disuelta en la disolución. Si la sustancia
es iónica se disolverá en sus iones.
CIC JULIO SÁNCHEZ](https://image.slidesharecdn.com/tema6-140126110617-phpapp02/85/Tema-6-35-320.jpg)

![En un electrolito de tipo AB el equilibrio de solubilidad viene
determinado por:
AB(s) ⇄ A+(ac) + B−(ac)
Conc. inic. (mol/l): c
0
0
Conc. eq. (mol/l): c
s
s
La concentración del sólido permanece constante.
Y la constante de equilibrio tiene la expresión:
K S = s ×s = s 2
s = KS
Si tenemos en cuenta Qps nos referiríamos a unas
condiciones cualesquiera:
Si Qps< Kps no hay precipitado. La dislución está
insaturada. Se puede disolver más sutancia
SI Qps= Kps Hay equilibrio. La disolución está saturada.
Se disuelve el sólido al igual que los iones precipitan.
Si Qps> Kps La disolución esta sobresaturada. Precipita
sustancia, hasta que disminuya la []CIC JULIOiones.
de SÁNCHEZ](https://image.slidesharecdn.com/tema6-140126110617-phpapp02/85/Tema-6-37-320.jpg)


![Supongamos que se estudia una disolución en las que están
disueltas dos sustancias con un ion común AgCl y AgNO3. Si el
AgNO3 se agrega a una disolución de AgCl . La adición del
efecto del ion común Ag+ hará que el producto iónico sea
mayor que el producto de solubilidad.
Q= [Ag+][Cl-]>Ks
Para restablecer el equilibrio precipitará parte del AgCl, como
predice el principio de Le Chatelier, hasta que el producto
iónico se a igual a Ks. El efecto de agregar un ion común es
entonces la disminución de la solubilidad de la sal AgCl. Se
observa que ahora [Ag+]>[Cl-]
CIC JULIO SÁNCHEZ](https://image.slidesharecdn.com/tema6-140126110617-phpapp02/85/Tema-6-40-320.jpg)
