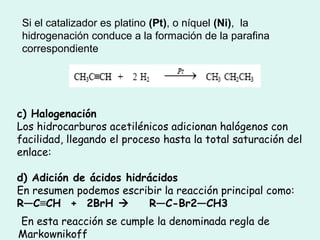
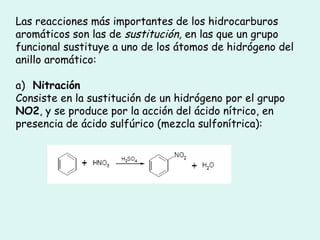
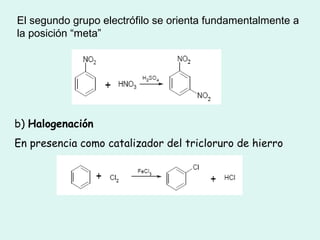
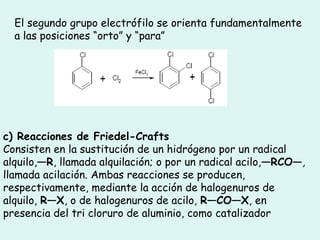
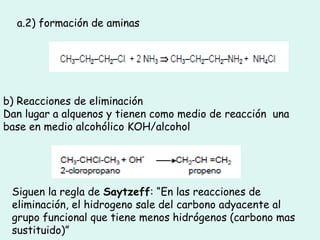
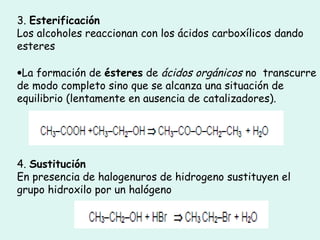
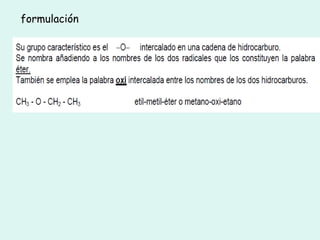
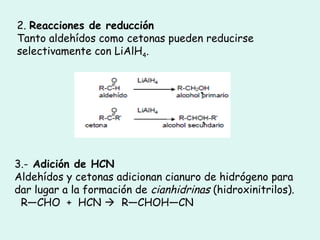
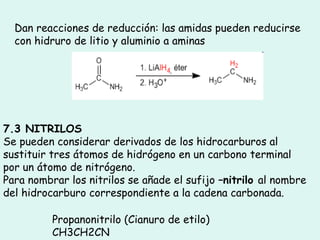
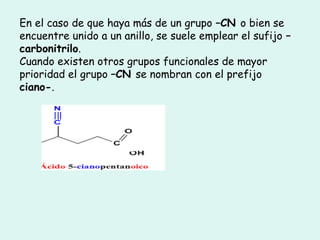
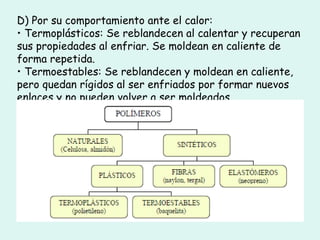
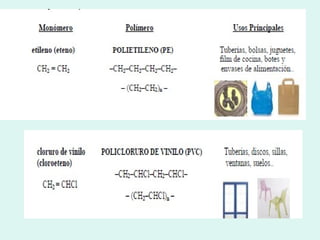
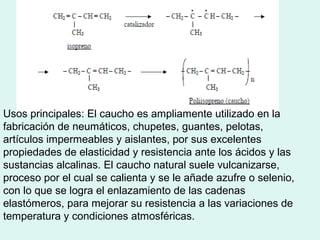
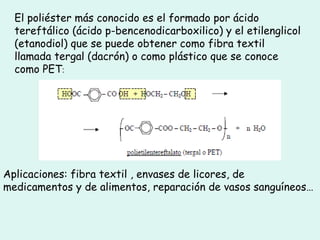
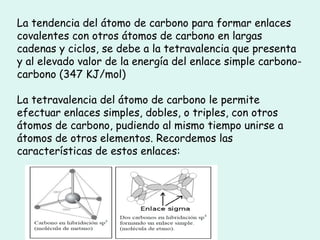
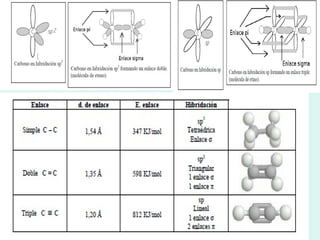
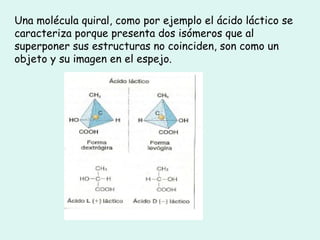
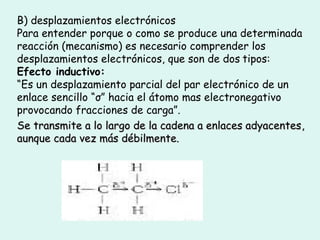
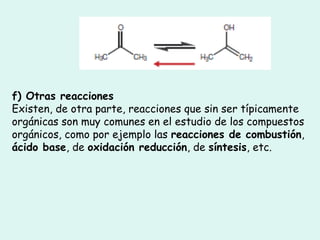
Este documento trata sobre química orgánica. Explica que los compuestos de carbono son esenciales para la vida y que hay más de 7 millones conocidos. Detalla las características del átomo de carbono que le permiten formar una gran variedad de compuestos, incluyendo su electronegatividad y tetravalencia. También describe los tipos principales de reacciones orgánicas como sustitución, adición, eliminación y condensación, e introduce los hidrocarburos como los compuestos orgánicos más simples.




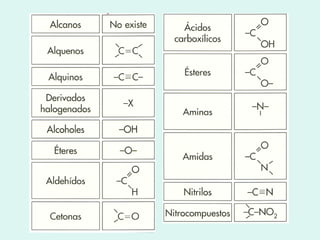








![4.2 Alcanos o parafinas Recordemos que se llama parafinas
o hidrocarburos saturados a aquellos que se caracterizan por
presentar exclusivamente enlaces simples carbono-carbono.
El nombre de parafinas (que hace referencia a su «pereza a
reaccionar» [parum: poco, affinis: afinidad], se dio
inicialmente a estos compuestos al observar que
prácticamente no reaccionaban con los reaccionantes más
corrientes](https://image.slidesharecdn.com/organicai-140424132525-phpapp02/85/Organica-i-22-320.jpg)