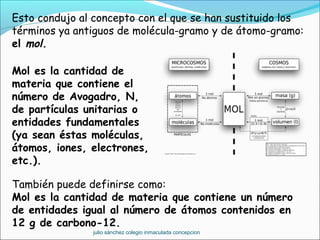
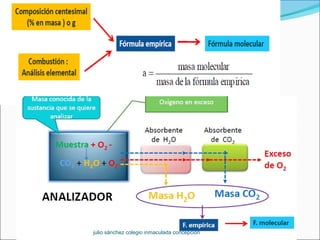
Este documento presenta las leyes fundamentales de la química, incluyendo las leyes ponderales, la teoría atómica de Dalton, y conceptos como el mol y el volumen molar. Explica que las leyes ponderales llevaron a Dalton a proponer su teoría atómica, la cual postula que los elementos están compuestos de átomos indivisibles y que las reacciones químicas implican la recombinación de átomos. También introduce conceptos como el mol, que representa una cantidad de sustancia contenente el número de Avogadro de