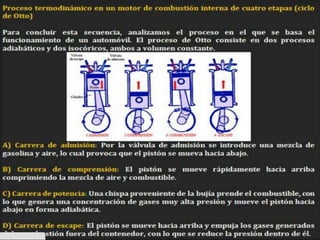
Este documento presenta las leyes empíricas de los gases ideales, incluyendo las leyes de Boyle, Charles, Gay-Lussac y Avogadro. También explica el modelo del gas ideal y cómo la relación de presión, volumen, número de moles y temperatura para un gas ideal se expresa como PV=nRT. Finalmente, concluye cómo estas relaciones se pueden usar para conocer propiedades de los gases y su capacidad para realizar trabajo.