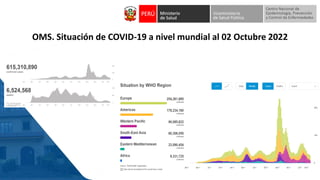
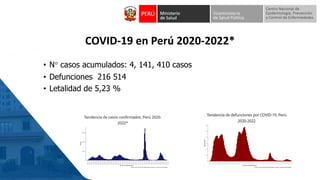
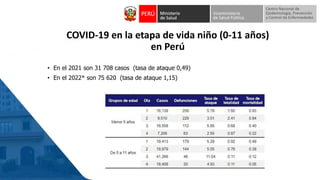
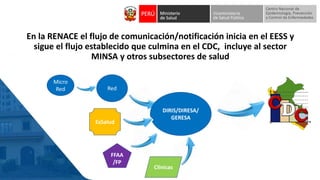
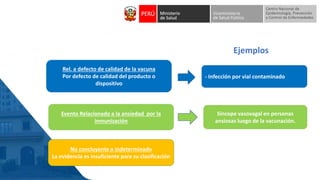
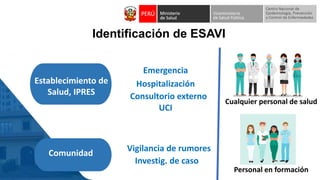
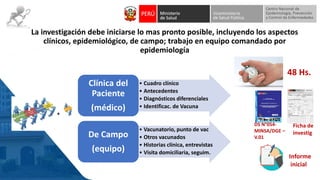
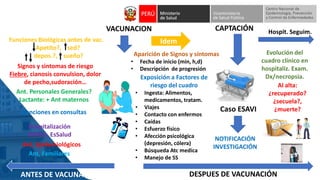
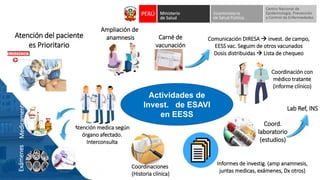
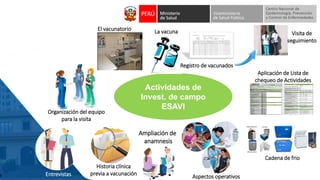
Este documento resume información sobre la vigilancia de eventos supuestamente atribuidos a la vacunación o inmunización (ESAVI) en el contexto de la vacunación contra la COVID-19 en niños entre 6 meses y 4 años en Perú. Incluye datos sobre casos y defunciones por COVID-19 en Perú, vacunas utilizadas contra la COVID-19, reacciones adversas reportadas en ensayos clínicos de la vacuna Moderna en niños, y detalles sobre la normativa y proceso de vigilancia de ESAVI graves en el país.