Josè ezequiel villarreal niño
- 2. Introducción. En física y química, la configuración electrónica indica la manera en la cual los electrones se estructuran o se modifican en un átomo de acuerdo con el modelo de capas electrónicas, en el cuál las funciones de ondas del sistema se expresa como un producto de orbitales antisimetrizadas.1 2 La configuración electrónica es importante porque determina las propiedades de combinación química de los átomos y por tanto su posición en la tabla periódica. La configuración electrónica en la corteza de un átomo es la distribución de sus electrones en los distintos niveles y orbitales. Los electrones se van situando en los diferentes niveles y subniveles por orden de energía creciente hasta completarlos. Es importante saber cuantos electrones existen en el nivel más externo de un átomo pues son los que intervienen en los enlaces con otros átomos para formar compuestos.
- 3. Objetivo: Analizar la estructura electrónica del átomo. Puntos a tratar: -Estructura atómica de los materiales. -Atracciones Inter-atómicas. -Comportamiento intermolecular de los materiales. -Tipos de interacciones. -Acomodamiento atómico.
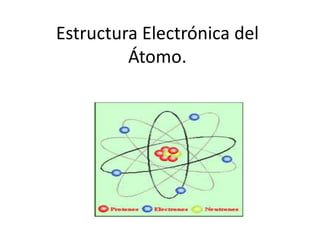
- 4. ESTRUCTURA ATÓMICA EN MATERIALES Los átomos son la unidad básica estructural de todos los materiales de ingeniería. Los átomos constan principalmente de tres partículas subatómicas básicas, protones neutrones y electrones. El modelo común consta de un pequeño núcleo de alrededor de 10-14 m de diámetro rodeado de una nube de electrones relativamente poco dispersa y de densidad variable de modo que el diámetro del átomo es del orden de 10-10 m. El Núcleo aglutina casi toda la masa del átomo y contiene protones y neutrones, el protón tiene una masa de 1.673*10-24g, y una carga unitaria de 1.602*10-19C. El neutrón el ligeramente más pesado que el protón con una masa de 1.675*10-24 g, pero no tiene carga. El electrón tiene una masa relativamente pequeña de 9.79*10-28 g. (1/1836 veces la del protón) y una carga de –1.602*10-19 C. (igual en carga pero de signo opuesto a la del protón. La nube de carga electrónica constituye de este modo casi todo el volumen del átomo, pero, sólo representa un pequeña parte de su masa. Los electrones, particularmente la masa externa determinan la mayoría de las propiedades mecánicas, eléctrica, químicas, etc., de los átomos, y así, un conocimiento básico de estructura atómica es importante en el estudio básico de los materiales de ingeniería.
- 5. Atracciones Inter-atómicas Uniones Interatómicas: Son las que se establecen entre los átomos. Hay de tres tipos. En dos de ellas, las llamadas Iónicas y Covalentes, los átomos tratan de llegar a completar el último nivel con ocho electrones cumpliendo con la clásica teoría del octeto de Lewis. La otra es la Unión metálica que se establece entre átomos iguales del mismo metal.
- 6. Uniones Iónicas: Aquellas que se realizan entre metales y no metales. Donde la diferencia de electronegatividad es importante. En estas uniones los electrones no se comparten sino que se ceden y se captan de forma absoluta, es decir, los metales electropositivos ceden electrones adquiriendo cargas positivas por tener protones en exceso. Y los no metales electronegativos los aceptan y completan así su último nivel energético. Se forman así cationes positivos y aniones negativos. Propiedades: -Las propiedades que distinguen a los compuestos iónicos son: -Tener puntos de fusión y ebullición elevados. Ser solubles en solventes polares como el agua. -Forman estructuras de redes cristalinas duras. -Presentan alta conductividad eléctrica en soluciones acuosas por ser iones. -Veremos un caso típico de una unión iónica. El sodio del grupo 1 con el cloro del grupo 7. Tienen bastante diferencia de electronegatividad. El sodio le cede al cloro el único electrón que tiene en su última capa o nivel energético. De esta manera el cloro completa su último nivel con ocho electrones. Quedan formados el catión sodio y anión cloro.
- 7. Comportamiento intermolecular de los materiales. -Las Fuerzas Intermoleculares, son fuerzas de atracción y repulsión entre las moléculas. El comportamiento molecular depende en gran medida del equilibrio (o falta de él) de las fuerzas que unen o separan las moléculas, y el estudio de esos fenómenos fue parte importante del desarrollo de la química física en el siglo XX. -Las fuerzas de atracción explican la cohesión de las moléculas en los estados liquido y sólido de la materia, y se llaman fuerzas de largo alcance o Fuerzas de Van der Waals en honor al físico holandés Johannes van der Waals. Estas fuerzas son las responsables de muchos fenómenos físicos y químicos como la adhesión, rozamiento, difusión, tensión superficial y la viscosidad. -Entre las diferentes fuerzas de orden intermoleculares que mantienen unidos los átomos dentro de la molécula y mantener la estabilidad de las moléculas individuales.
- 8. Algunos tipos de interacciones. : -Fuerzas de orientación (aparecen entre moléculas con momento dipolar diferente) -Fuerzas de inducción (ion o dipolo permanente producen en una molécula apolar una separación de cargas por el fenómeno de inducción electrostática) -Fuerzas de dispersión (aparecen en tres moléculas apolares). -En la naturaleza, las uniones entre molécula son de tipo dipolar, siendo las más características las fuerzas de Van der Waals y los puentes de hidrógeno. -Las fuerzas de atracción entre moléculas (monoatómicas o poli atómicas) sin carga neta se conocen con el nombre de fuerzas intermoleculares o fuerzas de van der Waals. Dichas fuerzas pueden dividirse en tres grandes grupos: las debidas a la existencia de dipolos permanentes, las de enlace de hidrógeno y las debidas a fenómenos de polarización transitoria (fuerzas de London). A continuación realizaremos un estudio elemental de cada uno de dichos grupos. -Fuerzas de Van der Waals: Es una fuerza intermolecular atractiva, pero poco intensa, que se ejerce a distancia entre moléculas. Son fuerzas de origen eléctrico que pueden tener lugar entre dipolos instantáneos o inducidos y entre dipolos permanentes.
- 9. Acomodamiento atómico. Se llama cristales a los acomodamientos atómicos repetitivos en las tres dimensiones. Esta repetición de patrones tridimensionales se debe a la coordinación atómica dentro del material, algunas veces este patrón controla la forma externa del cristal. El acomodamiento atómico interno persiste, aunque la superficie externa se altere. Los acomodamientos cristalinos pueden tomar uno de siete principales patrones de acomodamiento cristalino. Estos están estrechamente relacionados con la forma en la que se puede dividir el espacio en iguales volúmenes por superficies planas de intersección. Cristales Cúbicos. Los átomos pueden acomodarse en un patrón cúbico con tres diferentes tipos de repetición: cúbico simple (cs), cúbico de cuerpos centrados (ccc), y cúbico de caras centradas (ccc). -Cúbico simple. Es hipotética para metales puros, pero representa un buen punto de partida. Además de las tres dimensiones axiales a iguales y los ejes en ángulos rectos, hay posiciones equivalentes en cada celdilla. Cada celdilla tiene contornos idénticos al centro a los de todas las celdillas unitarias en el cristal. Del mismo modo, cualquier posición específica es idéntica en todas las celdillas unitarias. Cúbico de cuerpos centrados. Cada celdilla unitaria tiene un átomo en cada vértice del cubo y otro átomo en el centro del cuerpo -del cubo. -Cúbica de caras centradas. Este tipo de estructura se caracteriza por que en la esquina de cada celdilla unitaria y en centro de cada cara hay un átomo, pero no hay ninguno en el centro del cubo. -Cristales Hexagonales. Existen dos representaciones de las celdillas unitarias hexagonales simples. Este tipo de celdillas no tienen posiciones internas que sean equivalentes a las posiciones esquina. Además, existen estructuras hexagonales. Compactas que se caracterizan por tener cada átomo en una capa situada exactamente arriba o debajo de los intersticios entre tres átomos de las capas adyacentes. Así, cada átomo toca tres átomos de capa bajo un plano, seis átomos en su propio plano y tres en la capa superior. -Otros patrones cristalinos: No nos extenderemos más en cuanto a otros sistemas de cristales y retículas espaciales de otras estructuras cristalinas, por que los principios son comparables a los citados previamente.
- 10. -Cúbica de caras centradas. Este tipo de estructura se caracteriza por que en la esquina de cada celdilla unitaria y en centro de cada cara hay un átomo, pero no hay ninguno en el centro del cubo. -Cristales Hexagonales. Existen dos representaciones de las celdillas unitarias hexagonales simples. Este tipo de celdillas no tienen posiciones internas que sean equivalentes a las posiciones esquina. Además, existen estructuras hexagonales. Compactas que se caracterizan por tener cada átomo en una capa situada exactamente arriba o debajo de los intersticios entre tres átomos de las capas adyacentes. -Otros patrones cristalinos: No nos extenderemos más en cuanto a otros sistemas de cristales y retículas espaciales de otras estructuras cristalinas, por que los principios son comparables a los citados previamente.