ENZIMAS (4).pptx
- 1. ENZIMAS
- 2. Conoce la estructura, funciones moleculares e inhibición de las enzimas. COMPETENCIA.
- 3. CONTENIDO. Enzimas y catálisis biológica. Propiedades. Cinética enzimática. Clasificación. Regulación.
- 5. ESTRUCTURA •La gran mayoría de las enzimas son proteínas. •Sin embargo existen algunos ARN que pueden actuar como enzimas (ribozimas)
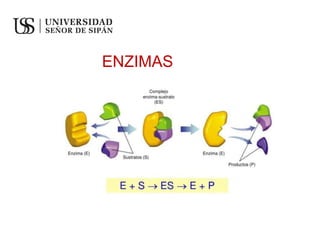
- 6. PARTES DE UNA ENZIMA
- 8. Los grupos químicos no proteínicos de las enzimas conjugadas se dividen en dos categorías: 1. Cofactores. De naturaleza inorgánica, frecuentemente iones metálicos, entre los más comunes están Fe2+, Cu1+, Mg2+, Mo2+, Mn2+ y Zn2+. 2. Coenzimas. Compuestos orgánicos, muchos de ellos derivados de vitaminas.
- 9. COENZIMAS •Molécula no proteica, de tamaño relativamente pequeño. • Se une a la enzima por uniones covalentes u otro tipo de enlace fuerte. •Están relacionadas con vitaminas •Una coenzima puede unirse a distintas apoenzimas y actuar en diferentes sustratos • Ejemplo. •Lactato deshidrogenasa, malato deshidrogenasa, glutamato deshidrogenasa y otras oxidorreductasas, utilizan la misma coenzima, nicotinamida adenina dinucliótido (NAD)
- 10. Coenzima de naturaleza no vitamínica Hemo Hemoenzimas, citocromos Complejos Fe-S Ferredoxinas Glutatión Redox; transporte de aminoácidos ATP Transf.de fosfato y/o de energía UTP Transf.de grupos glicosídicos PAPS Transf.de grupos sulfato S-AM Transf.de grupos metilo Carnitina Transportador de grupos acil.
- 13. CLASIFICACION 1) OXIDOREDUCTASAS: Catalizan reacciones de oxidoreducción. Asociadas a coenzimas Comprenden : Deshidrogenasas: el sustrato dona hidrógenos y los acepta la coenzima. Oxidasas : Aceptor de hidrógeno es el oxígeno Peroxidasas: Utilizan el H₂O₂ para oxidar el sustrato Oxigenasas: Incorporan oxígeno al sustrato
- 14. EJEMPLO
- 15. 2) TRANSFERASAS: Transfieren grupo de átomos de un donante a un aceptor.( amina, carboxilo, carbonilo, metilo, acilo, glicosilo , fosforilo)
- 16. 3) HIDROLASAS: Ruptura de enlaces C-O, C-N, C-S y O-P por adición de agua. Ejemplo la amilasa salival.
- 17. 4) LIASAS: Ruptura de uniones C -C, C-S y C-N , incluyendo uniones peptídicas
- 18. 5) ISOMERASAS : Interconvieten isómeros de cualquier tipo , ópticos, geométricos o de posición.
- 19. 6) LIGASAS: Catalizan uniones entre C-C ,C-S, C-O o C-N
- 20. Funciones de las Enzimas. Las enzimas cumplen funciones de : 1. Catálisis. La mayoría de las reacciones químicas del metabolismo son lentas, las enzimas aceleran las reacciones permitiendo que el metabolismo se efectúe a la velocidad que las células requieren. 2. Dirección. Las enzimas no permiten la formación de productos secundarios, de esta manera evitan que se pierdan precursores y energía que la célula necesita; esta característica también se conoce como catálisis negativa. 3. Control. La actividad de las enzimas se puede regular para ajustarla a las necesidades del metabolismo. La velocidad del metabolismo es determinada por las enzimas. 4. Acoplamiento. Las enzimas son los agentes encargados de acoplar reacciones no permitidas con reacciones espontáneas, permitiendo que se realicen.
- 21. ACTIVIDAD ENZIMATICA •Puede determinarse mediante la cantidad de producto formado, o de sustrato • Se mide la velocidad inicial (20%) •Cantidad de enzima se indica en UI •Unidad de cualquier enzima es la cantidad que cataliza la transformación de un micromol (μmol= 10⁻⁶) de sustrato por minuto
- 22. CINETICA E INHIBICION ENZIMATICA CINETICA ENZIMATICA La cinética enzimática estudia el mecanismo, velocidad y los factores que modifican las reacciones catalizadas por enzimas.
- 23. CINETICA A) CONCENTRACION DE ENZIMA. Cuando se determina la velocidad inicial, se puede establecer la relación entre cantidad de enzima y velocidad (equivalente a actividad enzimática). La velocidad es directamente proporcional a la concentración de enzima.
- 24. B) CONCENTRACION DE SUSTRATO. E + S ES E +P ECUACIÓN DE MICHAELIS-MENTEN Vmax [S] V0 = --------------- KM + [S] Cuando V0 = Vmax/2 KM = [S] Es decir, la constante de Michaelis corresponde a la concentración de sustrato cuando la velocidad inicial es la mitad de la velocidad máxima Concentración de sustrato, [S] Velocidad, V
- 25. C)TEMPERATURA •La velocidad de muchas reacciones biológicas se duplican por cada 10⁰C de aumento de temperatura. •Para la gran mayoría de enzimas , la temperatura óptima esta alrededor de 37 ⁰C •Alrededor de los 60⁰C se inactivan las enzimas
- 26. D) pH •Para la mayoría de enzimas, la actividad optima se encuentra entre pH 6 - 8. •Hay algunas excepciones: pepsina del jugo gástrico pH alrededor de 1.5 Fosfatasa ácido pH 5 Fosfatasa alcalina pH 9.5
- 27. VIDEO: INHIBIDORES ENZIMÁTICOS • https://www.youtube.com/watch?v=8k7VDEWNcsE
- 28. INHIBICION ENZIMATICA INHIBIDORES IRREVERSIBLES. •Producen cambios permanentes en la mólecula de enzima, con deterioro definitivo de su capacidad catalítica •Venenos organoforados – acetilcolinesterasa , enzima muy importante en el sistema nervioso. •Inhibidores suicidas .Ejemplo Alopurinol, inhibidor de la xantina oxidasa , utilizada en el tratamiento de la gota.
- 29. INHIBIDORES REVERSIBLES 1)INHIBIDORES COMPETITIVOS a)El inhibidor presenta similitud estructural con el sustrato y ambos compiten por el sitio activo de la enzima. b) Se unen al sitio activo de la enzima a pesar que no presentan similitud estructural con el sustrato. Ejemplo. Salicilato, inhibidor competitivo de alcohol deshidrogenasa y 3- fosfoglicerato quinasa. c)Inhibidor y sustrato se fijan a diferentes sitios de la enzima
- 32. 2)INHIBIDORES NO COMPETITIVOS •Se une a la enzima en un lugar de la molécula diferente del sitio activo. •La unión del sustrato con la enzima no esta afectada, el inhibidor se une ya sea en la enzima libre o al complejo. •Los iones metálicos , como Cu, Hg y Ag inhiben enzimas combinándose con grupos - SH( Tiol)
- 35. 3) INHIBIDORES ANTICOMPETITIVOS. •El inhibidor se une al complejo ES y forma el complejo inactivo ESI. •Hay dos reacciones que consumen ES, una que forma el producto y otra a ESI. •Este tipo de inhibición se da cuando participan varios sustratos en la reacción.
- 38. ENZIMAS ALOSTERICAS •En enzimas alostèricas, además del sitio catalítico, existen otros sitios reguladores. •Estos agentes reciben el nombre de moduladores , modificadores o efectores alostèricos •La enzima alostèrica, esta constituida por varias subunidades polipeptídicas .
- 40. Inhibición por producto final Inducción enzimática
- 42. MODIFICACION COVALENTE •La regulación covalente se realiza en varias enzimas por unión o eliminación de grupos unidos covalentemente. •Ejemplo unión o eliminación de fosfatos. •Fosforilaza b , es convertida en fosforilaza a, activa, por adición de fosfato al hidroxilo de residuos de serina en la molécula de la enzima.
- 45. Referencias: BAYNES J. y M. DOMINICZAK. Bioquímica Médica. Tercera Edición. Barcelona España: ELSEVIER MOSBY ESPAÑA, S.L.; 2011. BLANCO A. y G. Blanco. Química Biológica. Barcelona. España: Editorial El Ateneo; 2014 FERRIER D. Bioquímica. Sexta Edición. Barcelona. España: Editorial Wolters Klumer; 2014 DEVLIN T. BIOQUÍMICA. Libro texto con Aplicaciones Clínicas. 4ta. Edición. Barcelona. España: Editorial Reverté, S.A.; 2014 Conclusiones: Las enzimas son biomoléculas que aceleran la reacción en los procesos metabólicos, estas son reguladas por el sustrato , producto final, inhibidores e inhibición genética .