Enzimas 2021.ppt
- 2. CATALIZADOR Un catalizador es una sustancia que acelera una reacción química, hasta hacerla instantánea o casi instantánea. Existen catalizadores orgánicos (enzimas) e inorgánicos (iones metálicos).
- 4. CONCEPTO DE ENZIMA - Las enzimas son CATALIZADORES muy potentes y eficaces. - Químicamente son proteínas (excepto ribozimas y ribosomas)
- 5. Propiedades de los catalizadores en general • Actúan en pequeña cantidad, no se utilizan en concentraciones estequiométricas (eficientes). • No llevan a cabo reacciones que sean energéticamente desfavorables o imposibles. • No forman parte de la reacción que catalizan. • No se consumen en la reacción que catalizan. • No modifican la constante de equilibrio Keq.
- 6. Energía de activación • Para que una reacción química se lleve a cabo, es necesario suministrar una cierta cantidad de energía a las moléculas de reactivo. • La energía de activación se refiere a la barrera energética que hay que vencer para que tenga lugar la reacción química.
- 7. Propiedades de los catalizadores en general • Disminuyen la energía de activación, no modifican el ∆G.
- 8. Características específicas de las enzimas a) Ser específicas b) Termolábiles, c) Regulables
- 9. Especificad de la enzima
- 10. ELEMENTOS DE UNA REACCIÓN ENZIMÁTICA SITIO ACTIVO Es una pequeña porción de la enzima. Es una zona tridimensional en la que encaja el SUSTRATO Molecula(s) que va a ser transformada por la enzima ESPECIFICIDAD
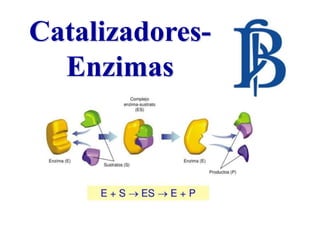
- 11. ENZIMAS Y SUSTRATOS La sustancia sobre la cual actúa una enzima se conoce como sustrato. El sustrato se convierte en uno o más productos nuevos. Las enzimas son reutilizables y cada una puede catalizar de 100 a 30,000,000 de reacciones /min. Pero, una enzima particular actúa solo sobre un sustrato específico. Cada enzima particular puede controlar solo un tipo de reacción.
- 12. La acción enzimática se caracteriza por la formación de un complejo que representa el estado de transición. El sustrato se une a la enzima por numerosas interacciones débiles en un lugar específico, el sitio activo que es una pequeña porción de la enzima constituída por una serie de aminoácidos que interaccionan con el sustrato. MECANISMOS DE ACCIÓN
- 15. 1. Oxirreductasas Piruvato deshidrogenasa • Deshidrogenasas – Requieren la presencia de cofactores (NAD+, NADP+, FAD, FMN) que aceptan o ceden los electrones. • Enzimas que utilizan oxígeno – Oxidasas – Oxigenasas – Peroxidasas – Catalasa
- 16. 2. Transferasas •Transfieren grupos funcionales entre dadores y aceptores. •Los principales grupos transferidos son grupos monocarbonados, amino, acilo, glucosilo y fosfato. Ejemplos: aminotransferasas, quinasas.
- 17. 3. Hidrolasas • Introducen una molécula de agua en el sitio de rotura (hidrólisis). La reacción generalizada implica la rotura hidrolítica de enlaces C–O, C–N, O–P y C–S. Participan en las reacciones de obtención de monómeros a partir de polímeros. Ejemplo: glucosidasas, lipasas, peptidasas.
- 18. 4. Liasas • Realizan rotura de enlaces covalentes sin la incorporación de agua. Ejemplos: descarboxilasas, deshidratasas, sintasas.
- 19. 5. Isomerasas • Catalizan procesos de reordenamientos intramoleculares Suelen actuar en procesos de interconversión de moléculas. Ejemplo: epimerasas, mutasas.
- 20. 6. Ligasas • Participan en reacciones sintéticas en las que se unen dos moléculas a expensas de sustancias de alto valor energético (como el ATP). El término sintetasa se reserv para este grupo particular de enzimas. Ejemplos: sintetasas, carboxilasas. Piruvato carboxilasa
- 21. Cofactores enzimáticos Apoenzima + cofactor no proteico = Holoenzima • Iones metálicos • Coenzimas • Grupos prostéticos La unión Enzima–Cofactor es temporal y débil, salvo cuando se trata de grupos prostéticos que es permanente. • No se modifican irreversiblemente • No son específicos • Son termoestables Agentes auxiliadores, necesarios para algunas enzimas Derivados de vitaminas
- 23. Cofactores enzimáticos Cuadro 2: Vitaminas precursores de coenzimas y grupos prostéticos Coenzima Vitamina Reacci ón en que particip Pirofosfato de Tiamina Tiamina (B1) Transferencia de aldehídos Flavina adenina dinucleótido (FAD) Riboflavina (B2) Oxidorreducción Flavina adenina mononucleótido (FMN) Riboflavina (B2) Oxidorreducción Nicotinamida adenina dinucleótido (NAD) Nicotinamida Oxidorreducción Nicotinamida adenina dinucleótido fosfato (NADP) Nicotinamida Oxidorreducción Coenzima A (CoA) Ácido pantoténico Transferencia de grupos a Fosfato de piridoxal Piridoxina (B6) Transferencia de grupos a Biotina Biotina Carboxilación Tetrahidrofolato Ácido fólico Transferencias de un carb Coenzimas cobamídicas Cobalamina (B12) AlquilacióI nUCS, Fundación H. A. Barceló Bioqu ímica Dr. Gustavo M. Bertot Cofactores
- 24. Cinética enzimática • La cinética enzimática estudia la velocidad de las reacciones químicas que son catalizadas por las enzimas. • La velocidad de catálisis de una enzima podría determinarse bien como velocidad a la que se forma el producto, o bien como velocidad a la que desaparece el sustrato. • La concentración de sustrato afecta de manera muy importante a la velocidad de la enzima • Cuando se mantiene constante la concentración del enzima, al aumentar la concentración de sustrato la velocidad de la enzima crece linealmente hasta alcanzar una meseta que corresponde a un valor de velocidad máxima (enzima saturada).
- 25. Efecto de [S] sobre la velocidad de la reacción catalizada por un enzima que une un único sustrato
- 26. Cinética enzimática • Los principios generales de la cinética de las reacciones químicas son aplicables a las reacciones catalizadas por enzimas. • Estas reacciones poseen (además del fenómeno de la especificidad, un rasgo característico que no se observa en los catalizadores no enzimáticos, la saturación con el sustrato, entendida en términos de ocupación de los centros activos de todas las moléculas de enzima.
- 27. - A bajas [S], la velocidad es directamente proporcional a [S] (lineal) y la cinética se denomina de primer orden. - En la zona intermedia de [S] la velocidad del proceso deja de ser lineal, y a esta zona se la denomina de cinética mixta. - A altas [S], la velocidad de la reacción se hace prácticamente constante e independiente de la [S], la cinética se considera de orden
- 28. Este comportamiento es característico de muchas enzimas y fue estudiado por Michaelis y Menten en 1913. A partir de la figura se definen dos parámetros cinéticos de gran importancia, que son característicos de cada enzima, la velocidad máxima (Vmax), y la constante de Michaelis (Km). Permiten explicar cómo funciona una enzima, y predecir cómo se comportará esa enzima in vivo.
- 29. La Vmax se obtiene cuando la velocidad de reacción se hace independiente de la concentración de sustrato. Este valor depende de la cantidad de enzima que tengamos. Es la velocidad que se alcanza cuando la enzima se satura.
- 30. La Km nos indica la concentración de sustrato a la cuál la velocidad de reacción es la mitad de la velocidad máxima, es independiente de la concentración de enzima, y es característico de cada enzima según el sustrato utilizado (si tiene varios). También nos indica la afinidad que posee la enzima por el sustrato (relación inversa)
- 31. Los parámetros cinéticos podrían obtenerse a partir de la curva de Michaelis-Menten, pero no es muy preciso debido a que la aproximación Vmax se hace asintóitica.
- 32. Existen métodos gráficos más fiables que facilitan el cálculo de Km y Vmax. Se hacen en base a transformaciones matemáticas de la ecuación de Michaelis y entre ellas la más utilizada es la representación de Lineweaver-Burk también conocida como dobles-inversos o recíprocos.
- 33. Transformación de la ecuación por dobles recíprocos Linewearver–Burke
- 34. Transformación de la ecuación por dobles recíprocos Linewearver–Burke -5 2 1/Vmáx=2 1= 2 x Vmáx ½= Vmáx 0,5= Vmáx -1/Km= -5 1/Km= 5 1= Km x 5 1/5= Km 0,2=Km
- 35. Factores que afectan la actividad de una enzima -pH -Temperatura -Concentración de sustrato -Concentración de enzimas
- 36. El punto óptimo representa el máximo de actividad. A temperaturas bajas, las enzimas se hallan "muy rígidas" y cuando se supera un valor considerable (mayor de 50 oC) la actividad cae bruscamente porque, como proteína, la enzima se desnaturaliza. EFECTO DE LA TEMPERATURA 100 0 70 Temperatura óptima % de la actividad Máxima de la enzima Temperatura ºC
- 37. EFECTOS DEL PH Al comprobar experimentalmente la influencia del pH en la velocidad de las reacciones enzimáticas se obtienen curvas que indican que las enzimas presentan un pH óptimo de actividad. El pH puede afectarse de varias maneras: El centro activo puede contener aminoácidos con grupos ionizados que pueden variar con el pH. La ionización de aminoácidos que no están en el centro activo puede provocar modificaciones en la conformación de la enzima. El sustrato puede verse afectado por las variaciones del pH. Algunas enzimas presentan variaciones peculiares. La pepsina del estómago, presenta un óptimo a pH=2, y la fosfatasa alcalina del intestino a un pH= 12
- 38. EFECTOS DEL PH Máxima actividad enzimática
- 39. EFECTOS DE LA CONCENTRACIÓN DE SUSTRATO La velocidad inicial crece al aumentar la concentración de sustrato hasta el punto donde la enzima se satura Incrementos posteriores no afectan la velocidad Vmax Vi Km [ S ] Vmax/2 Vmax/2 . . . A B C A: solo una pequeña porción de E está saturada con S B: la mitad de las Enzimas están saturadas con el Sustrato C: la totalidad de las E se encuentran saturadas con el sustrato
- 40. • Concentración de enzima IUCS, Fundación H. A. Barceló Bioqu ímica Dr. Gustavo M. Bertot
- 41. Inhibición enzimática • Muchas sustancias alteran la actividad de una enzima combinándose con ella en una forma que influencia la unión con el sustrato y/o su número de recambio. Las sustancias que reducen la actividad de una enzima de esta manera se conocen como inhibidores. • Estos inhibidores pueden unirse a las enzimas de forma reversible (la desaparición del inhibidor restaura la actividad enzimática) o irreversible (el inhibidor inactiva permanentemente a la enzima). Los inhibidores irreversibles usualmente reaccionan con la enzima y cambian su estructura química.
- 42. • Irreversibles – Modifican una enzima covalentemente, y por lo tanto la inhibición no puede ser revertida. • Reversibles – Se unen a la enzima con interacciones no covalentes. • Competitivos • No competitivos • Acompetitivos M. Bertot
- 43. • Inhibidores reversibles competitivos – Una sustancia que compite directamente con el sustrato el sitio activo. – Se asemejan al sustrato, por lo tanto se une en forma específica al sitio activo de la enzima, pero como difiere del sustrato no puede reaccionar como lo hace éste. – Estos inhibidores se pueden unir a E, pero no al ES. • Aumenta Km (es decir, el inhibidor interfiere con la unión del sustrato) • No afecta la Vmax.
- 45. • Inhibidores reversibles no competitivos – Sustancias que se unen a un sitio diferente del centro activo. – Los inhibidores tienen afinidades idénticas por E y ES. • No afecta Km (es decir, la unión del sustrato con la enzima) • Disminuye la Vmax.
- 47. • Inhibidores reversibles acompetitivos –Los inhibidores se unen solamente al complejo ES y no a la enzima libre. –El orden de fijación es importante ya que en la secuencia, se requiere que primero se une el S y después se fije el inhibidor. (Presumiblemente se produce una distorsión del sitio activo y por lo tanto, la enzima es catalíticamente inactiva.) • Disminuye la Vmax • Disminución de Km.
- 49. Tipo de inhibición Mecanismo Gráfico Lineweaver- Burke Km Vmax No competitiva: Los inhibidores tienen afinidades idénticas por E y ES. No afecta la unión del sustrato pero impide la formación del producto a partir de ES. Acompetitiva: Los inhibidores se unen solamente al complejo ES pero no a la E. Una fracción del complejo ES será desviada hacia la formación del complejo ESI. Mixta: No varía ↓ ↓ ↓
- 50. • Modifican una enzima covalentemente. • Estos inhibidores comúnmente contienen grupos funcionales reactivos como grupos nitrogenados, aldehídos, haloalcanos o alquenos que reaccionan con las cadenas de aminoácidos para formar uniones covalentes. • La inhibición irreversible es diferente de la inactivación enzimática irreversible. Los inhibidores irreversibles son generalmente específicos; no inactivan a todas las proteínas; no funcionan destruyendo la estructura proteica, sino alterando específicamente el sitio activo (temperaturas extremas usualmente causan la desnaturalización de todas las estructuras proteicas, pero este no es un efecto específico). Inhibición irreversible
- 51. REGULACIÓN ENZIMÁTICA Un organismo debe ser capaz de regular la actividad catalítica de sus componentes enzimáticos para coordinar los numerosos procesos metabólicos, responder a los cambios de su ambiente y crecer y diferenciarse, todo esto realizado de manera ordenada.
- 52. Algunas enzimas utilizan diferentes mecanismos para regular su actividad catalítica: • Zimógenos • Compartimentalización • Regulación alostérica • Regulación por modificación covalente • Regulación genética
- 53. Zimógenos: Enzimas secretadas en forma inactiva y que sufren ruptura proteolítica adquieren actividad catalítica o enzimática
- 55. Compartimentalización Funciones metabólicas de los orgánulos de los eucariontes Orgánulo Principales funciones Mitocondria Ciclo de Krebs , fosforilación oxidativa, oxidación de ácidos grasos, degradación de aminoácidos Citosol Glucólisis, vía de las pentosas , biosíntesis de ácidos grasos, muchas reacciones de gluconeogénesis Lisosoma Digestión enzim ática de los componentes celulares y de la materia ingerida Núcleo Replicación y transcripción del ADN, procesamiento del ARN Aparato de Golgi Procesamiento postraduccional de las proteínas de membrana y secretoras; formación de la membrana plasmática y ves ículas secretoras Ret ículo endoplasmático rugoso Síntesis de proteínas unidas a la membrana y secretoras Ret ículo endoplasmático liso Bios íntesis de lípidos y esteroides Peroxisomas Reacciones oxidativas catalizadas por aminoácido oxidasas y catalasa; reacciones del ciclo del glioxilato en plantas
- 56. Regulación alostérica Características de enzimas alostéricas: - Proteínas oligoméricas - Forma tensa y relajada - El pasaje de una estructura a otra se da por aumento de la concentración de sustratos o la presencia de moduladores - Cinética sigmoidea - Sitio alostérico - Regulación por moduladores
- 59. Cinética sigmoidea frente a moduladores
- 60. Cinética de enzimas Michelianas versus alostéricas
- 61. Regulación covalente • Las formas activas e inactiva de una enzima pueden ser interconvertidas por modificaciones covalentes de sus estructuras que son catalizadas por otras enzimas. • Transferencia del grupo fosfato terminal del ATP a una serina, treonina o tirosina específica de la enzima (kinasa). • Eliminación hidrolítica de Pi (fosfatasas).